Trong thế giới của hóa học, tốc độ phản ứng không chỉ đơn thuần là một khái niệm lý thuyết mà còn thống trị quá trình diễn ra của mọi phản ứng. Vậy tốc độ phản ứng là gì? Hãy cùng dongachem.vn khám phá sâu hơn về khái niệm này và những ảnh hưởng của nó đến thế giới quanh ta.
Định nghĩa tốc độ phản ứng là gì?
Tốc độ phản ứng là đại lượng đặc trưng cho sự nhanh chậm của một phản ứng hóa học. Nói cách khác, nó cho biết lượng chất tham gia phản ứng biến đổi thành sản phẩm trong một đơn vị thời gian.
Ví dụ: Khi đốt một tờ giấy, nếu giấy cháy hết trong 10 giây, ta nói rằng phản ứng cháy xảy ra với tốc độ nhanh hơn so với khi đốt một khúc gỗ.

Hình ảnh minh họa cho tốc độ phản ứng
Các yếu tố ảnh hưởng tới tốc độ phản ứng
Có nhiều yếu tố ảnh hưởng đến tốc độ của một phản ứng hóa học, bao gồm:
-
Nồng độ: Khi tăng nồng độ của chất tham gia, số lần va chạm giữa các phân tử tăng lên, do đó tốc độ phản ứng cũng tăng.
-
Nhiệt độ: Nâng cao nhiệt độ làm tăng năng lượng động của các phân tử, khiến chúng va chạm mạnh hơn và thường xuyên hơn, từ đó tăng tốc độ phản ứng.
-
Áp suất: Đối với các phản ứng có chất khí tham gia, tăng áp suất sẽ làm tăng nồng độ của chất khí, dẫn đến tăng tốc độ phản ứng.
-
Diện tích bề mặt tiếp xúc: Đối với các phản ứng có chất rắn tham gia, tăng diện tích bề mặt tiếp xúc sẽ làm tăng số lượng các phân tử tiếp xúc, từ đó tăng tốc độ phản ứng.
-
Chất xúc tác: Chất xúc tác là chất làm tăng tốc độ phản ứng mà bản thân nó không bị biến đổi về lượng. Chất xúc tác làm giảm năng lượng hoạt hóa của phản ứng, giúp các phân tử dễ dàng vượt qua hàng rào năng lượng để chuyển hóa thành sản phẩm.
Phương trình tốc độ phản ứng
Phương trình tốc độ phản ứng mô tả mối quan hệ giữa tốc độ phản ứng và nồng độ của các chất tham gia. Ví dụ, đối với phản ứng:
aA + bB → cC + dD
Phương trình tốc độ có dạng tổng quát:
v = k[A]m[B]n
Trong đó:
-
v: Tốc độ phản ứng
-
k: Hằng số tốc độ phản ứng
-
[A], [B]: Nồng độ của chất A và B
-
m, n: Thứ tự phản ứng đối với chất A và B
Phương trình tốc độ phản ứng có ý nghĩa gì trong thực tế?
Phương trình tốc độ phản ứng có ý nghĩa rất quan trọng trong thực tế, nó giúp chúng ta:
-
Dự đoán tốc độ phản ứng: Biết được tốc độ phản ứng sẽ thay đổi như thế nào khi thay đổi nồng độ, nhiệt độ, áp suất...
-
Điều khiển tốc độ phản ứng: Điều chỉnh các yếu tố ảnh hưởng để tăng hoặc giảm tốc độ phản ứng theo mục đích.
-
Tối ưu hóa quá trình sản xuất: Trong công nghiệp hóa chất, việc điều chỉnh tốc độ phản ứng giúp tăng hiệu suất và giảm chi phí sản xuất.
-
Nghiên cứu cơ chế phản ứng: Phương trình tốc độ giúp các nhà khoa học hiểu rõ hơn về cơ chế diễn ra của phản ứng hóa học.
Ví dụ:
-
Trong sản xuất phân bón: Người ta tăng nhiệt độ và áp suất để tăng tốc độ tổng hợp amoniac, từ đó sản xuất được nhiều phân bón hơn.
-
Trong sản xuất dược phẩm: Việc điều chỉnh tốc độ các phản ứng tổng hợp thuốc giúp đảm bảo chất lượng và hiệu quả của thuốc.
Các loại tốc độ phản ứng và ví dụ minh họa
Tốc độ phản ứng là một khái niệm quan trọng trong hóa học, nó cho biết sự nhanh chậm của một phản ứng hóa học. Tùy thuộc vào tốc độ phản ứng, ta có thể chia các phản ứng thành nhiều loại khác nhau.

Các loại tốc độ phản ứng và ví dụ minh họa
1. Phản ứng nhanh:
2. Phản ứng chậm:
3. Phản ứng có tốc độ trung bình:
Ứng dụng của tốc độ phản ứng trong thực tiễn
Tốc độ phản ứng, hay nói cách khác là sự nhanh chậm của một phản ứng hóa học, đóng vai trò vô cùng quan trọng trong nhiều lĩnh vực của cuộc sống. Việc hiểu và điều chỉnh tốc độ phản ứng giúp chúng ta tối ưu hóa các quá trình sản xuất, đảm bảo an toàn và hiệu quả.

Ứng dụng của tốc độ phản ứng trong thực tiễn
1. Công nghiệp Hóa Chất
2. Công nghiệp Thực phẩm
-
Bảo quản thực phẩm:
-
Làm chậm quá trình oxi hóa: Bằng cách giảm tiếp xúc của thực phẩm với không khí, sử dụng chất chống oxy hóa, chúng ta có thể làm chậm quá trình oxi hóa, giúp thực phẩm tươi lâu hơn.
-
Kiểm soát quá trình lên men: Trong sản xuất các sản phẩm lên men như sữa chua, rượu vang, tốc độ lên men được điều chỉnh để đảm bảo chất lượng sản phẩm.
-
Chế biến thực phẩm:
-
Nấu ăn: Nhiệt độ cao làm tăng tốc độ phản ứng hóa học trong quá trình nấu ăn, giúp thức ăn chín nhanh hơn.
-
Lên men: Quá trình lên men được điều chỉnh để tạo ra các sản phẩm thực phẩm như bánh mì, bia.
3. Y học
4. Môi trường
-
Xử lý nước thải:
-
Giảm thiểu ô nhiễm:
5. Pin và Ắc quy
So sánh tốc độ phản ứng trong các điều kiện khác nhau
Tốc độ phản ứng là một yếu tố quan trọng trong hóa học, nó quyết định sự nhanh chậm của một quá trình hóa học. Tốc độ này có thể thay đổi đáng kể tùy thuộc vào các điều kiện phản ứng. Dưới đây là một số so sánh về tốc độ phản ứng trong các điều kiện khác nhau:
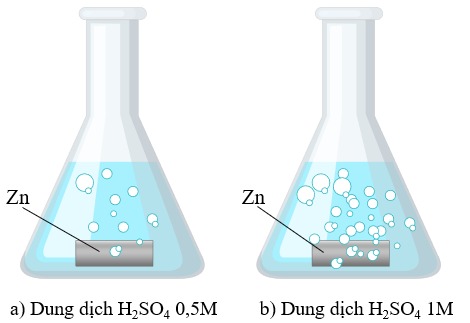
Nồng độ có ảnh hưởng tới tốc độ phản ứng
1. Ảnh hưởng của Nhiệt Độ
-
Nhiệt độ cao: Tăng nhiệt độ làm tăng năng lượng động của các phân tử, khiến chúng va chạm nhau mạnh hơn và thường xuyên hơn, từ đó tăng tốc độ phản ứng.
-
Ví dụ: Việc nấu ăn ở nhiệt độ cao giúp thức ăn chín nhanh hơn.
2. Ảnh hưởng của Nồng Độ
-
Nồng độ cao: Tăng nồng độ chất tham gia làm tăng số lượng các phân tử trong một đơn vị thể tích, tăng khả năng va chạm giữa các phân tử, do đó tăng tốc độ phản ứng.
-
Ví dụ: Một thanh magie cháy sáng hơn trong oxi nguyên chất so với trong không khí (oxi chiếm tỉ lệ nhỏ trong không khí).
3. Ảnh hưởng của Áp Suất
-
Đối với phản ứng có chất khí: Tăng áp suất làm tăng nồng độ của các chất khí, do đó tăng tốc độ phản ứng.
-
Ví dụ: Phản ứng tổng hợp amoniac từ nitơ và hydro được thực hiện ở áp suất cao để tăng hiệu suất.
4. Ảnh hưởng của Diện Tích Bề Mặt Tiếp Xúc
-
Đối với phản ứng có chất rắn tham gia: Tăng diện tích bề mặt tiếp xúc của chất rắn làm tăng số lượng các phân tử tiếp xúc, từ đó tăng tốc độ phản ứng.
-
Ví dụ: Việc nghiền nhỏ viên thuốc giúp thuốc tan nhanh hơn trong nước.
5. Ảnh hưởng của Chất Xúc Tác
-
Chất xúc tác: Làm tăng tốc độ phản ứng bằng cách cung cấp một con đường mới có năng lượng hoạt hóa thấp hơn.
-
Ví dụ: Enzyme trong cơ thể là chất xúc tác sinh học, giúp các phản ứng sinh hóa diễn ra nhanh chóng ở nhiệt độ cơ thể.
Dưới đây là bảng so sánh tóm tắt:
|
Yếu tố
|
Ảnh hưởng đến tốc độ phản ứng
|
Ví dụ
|
|
Nhiệt độ
|
Tăng nhiệt độ làm tăng tốc độ
|
Nấu ăn, đốt cháy
|
|
Nồng độ
|
Tăng nồng độ làm tăng tốc độ
|
Phản ứng cháy trong oxi nguyên chất
|
|
Áp suất (chất khí)
|
Tăng áp suất làm tăng tốc độ
|
Tổng hợp amoniac
|
|
Diện tích bề mặt tiếp xúc
|
Tăng diện tích bề mặt làm tăng tốc độ
|
Nghiền nhỏ viên thuốc
|
|
Chất xúc tác
|
Tăng tốc độ phản ứng
|
Enzyme trong cơ thể
|
Làm thế nào để tăng tốc độ phản ứng
Tốc độ phản ứng là yếu tố quan trọng trong nhiều quá trình hóa học, từ sản xuất công nghiệp đến các quá trình sinh học trong cơ thể chúng ta. Để tăng tốc độ phản ứng, chúng ta có thể tác động vào một số yếu tố sau:
1. Tăng Nhiệt Độ
-
Nguyên lý: Khi nhiệt độ tăng, các phân tử chuyển động nhanh hơn, va chạm mạnh hơn và thường xuyên hơn, từ đó tăng khả năng xảy ra phản ứng.
-
Ví dụ: Nấu ăn ở nhiệt độ cao giúp thức ăn chín nhanh hơn.
2. Tăng Nồng Độ Chất Tham Gia
-
Nguyên lý: Khi tăng nồng độ, số lượng các phân tử trong một đơn vị thể tích tăng lên, làm tăng tần suất va chạm giữa các phân tử, từ đó tăng tốc độ phản ứng.
-
Ví dụ: Đốt một mẩu giấy trong oxi nguyên chất sẽ cháy nhanh hơn trong không khí.
3. Tăng Áp Suất (Đối với Phản Ứng Có Chất Khí)
-
Nguyên lý: Tăng áp suất làm tăng nồng độ của các chất khí, tương tự như tăng nồng độ.
-
Ví dụ: Trong quá trình tổng hợp amoniac, tăng áp suất giúp tăng tốc độ phản ứng.
4. Tăng Diện Tích Bề Mặt Tiếp Xúc
-
Nguyên lý: Đối với phản ứng có chất rắn tham gia, tăng diện tích bề mặt tiếp xúc sẽ làm tăng số lượng các phân tử tiếp xúc, từ đó tăng tốc độ phản ứng.
-
Ví dụ: Nghiền nhỏ viên thuốc giúp thuốc tan nhanh hơn trong nước.
5. Sử Dụng Chất Xúc Tác
-
Nguyên lý: Chất xúc tác cung cấp một con đường mới để phản ứng xảy ra, với năng lượng hoạt hóa thấp hơn, giúp phản ứng diễn ra nhanh hơn.
-
Ví dụ: Enzyme trong cơ thể là chất xúc tác sinh học, giúp các phản ứng sinh hóa diễn ra nhanh chóng ở nhiệt độ cơ thể.
Lưu ý: Việc tăng tốc độ phản ứng không chỉ đơn thuần là tăng các yếu tố trên mà còn phải cân nhắc đến các yếu tố khác như chi phí, an toàn và hiệu quả của quá trình.
Qua những thông tin trên của dongachem.vn có thể thấy tốc độ phản ứng hóa học là một khía cạnh quan trọng trong ngành hóa học, đóng vai trò quyết định không chỉ trong nghiên cứu mà còn trong ứng dụng thực tiễn. Từ cách mà các yếu tố như nồng độ, nhiệt độ, diện tích bề mặt và chất xúc tác tác động đến tốc độ phản ứng, đến việc ứng dụng kiến thức này trong ngành công nghiệp, y học và thực phẩm, tất cả đều chứng tỏ rằng việc hiểu rõ tốc độ phản ứng là gì rất cần thiết.