Sodium hay natri, ký hiệu Na, là một trong những kim loại kiềm quan trọng nhất trong bảng tuần hoàn. Một điểm nổi bật của natri chính là số oxi hóa đặc trưng của nó, thường là +1. Điều này không chỉ khẳng định tính chất hóa học của natri mà còn mở ra nhiều ứng dụng thú vị trong lĩnh vực hóa học và công nghiệp. Vậy số oxi hóa của Na có những ý nghĩa và đặc điểm gì? Hãy cùng Đông Á Chemical tìm hiểu ngay dưới đây các bạn nhé!
Đặc điểm số oxi hóa của Na
Trong hầu hết các hợp chất, số oxi hóa của Na (Natri) là +1. Đây là một quy tắc quan trọng khi xác định số oxi hóa trong các hợp chất hóa học.
Lý do Na thường có số oxi hóa +1
-
Cấu hình electron: Na có 1 electron ở lớp vỏ ngoài cùng. Để đạt được cấu hình electron bền vững của khí hiếm, Na có xu hướng nhường đi 1 electron này.
-
Tính kim loại: Na là kim loại điển hình, có tính khử mạnh. Khi tham gia phản ứng hóa học, Na thường nhường electron để tạo thành ion Na+ mang điện tích dương.
Cách xác định số oxi hóa của Na trong hợp chất
Để xác định số oxi hóa của Na trong một hợp chất, bạn có thể áp dụng các quy tắc sau:
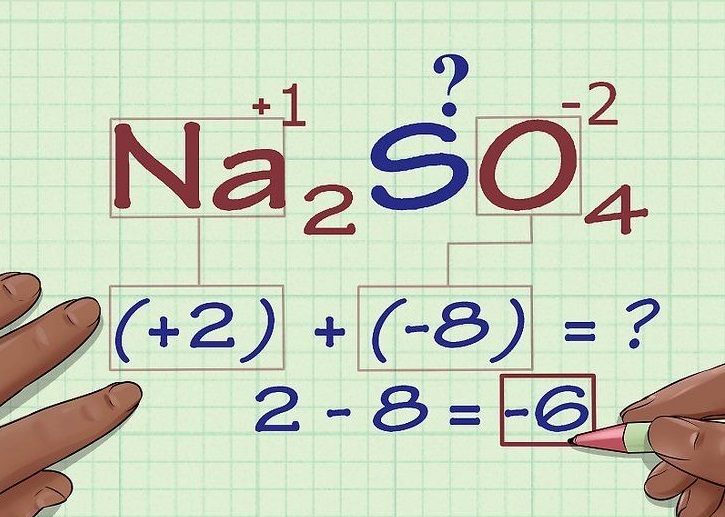
Cách xác định số oxi hóa của một chất trong hợp chất
-
Tổng số oxi hóa của các nguyên tử trong một phân tử bằng 0.
-
Số oxi hóa của các nguyên tố trong đơn chất bằng 0.
-
Một số nguyên tố thường có số oxi hóa cố định:
-
Kim loại nhóm IA (nhóm của Na) thường có số oxi hóa +1.
-
Oxi thường có số oxi hóa -2 (trừ một số trường hợp đặc biệt như peoxit, superoxit).
-
Hidro thường có số oxi hóa +1 (trừ khi liên kết với kim loại thì có số oxi hóa -1).
-
Các halogen (F, Cl, Br, I) thường có số oxi hóa -1.
Ví dụ: Trong hợp chất NaCl:
Sự thay đổi số oxi hóa của Na trong các phản ứng hóa học
-
Trong hầu hết các phản ứng hóa học, số oxi hóa của Na không thay đổi và luôn bằng +1. Điều này là do Na có tính khử mạnh và thường nhường electron để tạo thành ion Na+.
-
Tuy nhiên, trong một số điều kiện đặc biệt, Na có thể tham gia vào các phản ứng phức tạp hơn và số oxi hóa của nó có thể thay đổi. Nhưng đây là những trường hợp hiếm gặp và thường xảy ra trong các điều kiện phòng thí nghiệm đặc biệt.
Số oxi hóa +1 là số oxi hóa đặc trưng của Na trong hầu hết các hợp chất. Việc hiểu rõ về số oxi hóa của Na giúp chúng ta dự đoán được tính chất hóa học của các hợp chất chứa Na và viết được các phương trình hóa học một cách chính xác.
Tính chất hóa học của Na với số oxi hóa +1
Khi Na có số oxi hóa +1, nó tồn tại dưới dạng ion Na+. Ion này có tính chất hóa học đặc trưng của một cation kim loại kiềm. Tính chất hóa học chính của ion Na+ gồm:
Tính chất hóa học của Na với số oxi hóa +1
-
Tính khử:
-
Yếu hơn kim loại Na: Khi đã nhường electron để trở thành ion Na+, khả năng nhường electron tiếp theo của nó giảm đi đáng kể.
-
Không khử được nước: Khác với kim loại Na phản ứng mạnh với nước, ion Na+ không có khả năng này.
-
Có thể bị khử thành Na kim loại: Trong một số điều kiện điện phân nóng chảy muối NaCl, ion Na+ có thể nhận electron trở lại và tạo thành kim loại Na.
-
Tạo hợp chất ion:
-
Với các anion: Ion Na+ kết hợp với các anion (như Cl-, SO₄²⁻, NO₃⁻) tạo thành các hợp chất ion bền vững. Ví dụ: NaCl, Na₂SO₄, NaNO₃.
-
Tính tan: Hầu hết các hợp chất của Na đều tan tốt trong nước.
-
Tính bền:
Các phản ứng hóa học đặc trưng
-
Phản ứng trung hòa: Na⁺ + OH⁻ → NaOH
-
Phản ứng tạo kết tủa: Ag⁺ + Cl⁻ → AgCl↓
-
Phản ứng trao đổi ion: Na₂CO₃ + 2HCl → 2NaCl + H₂O + CO₂↑
Ứng dụng của số oxi hóa của natri trong hóa học
Số oxi hóa của natri (+1) đóng vai trò quan trọng trong việc:
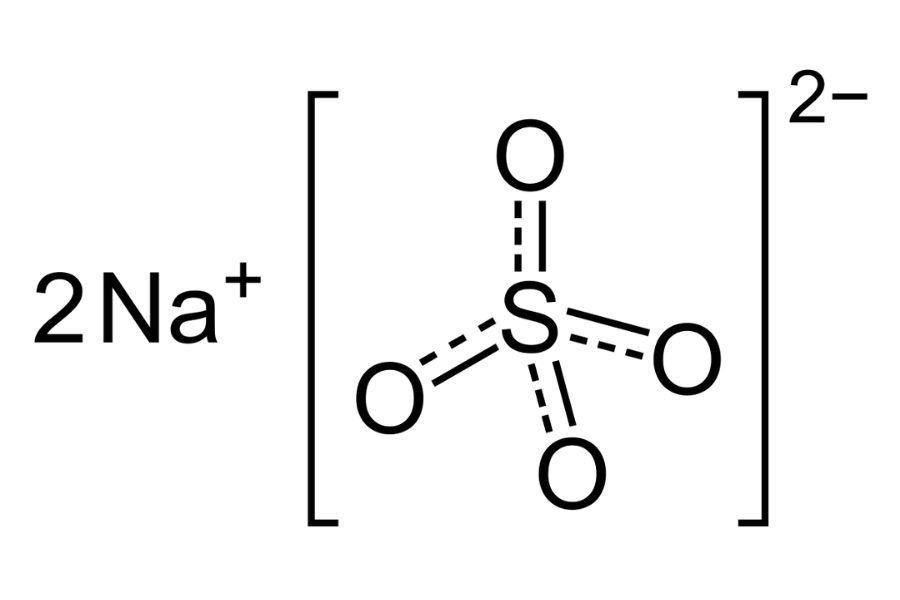
Ứng dụng của số oxi hóa của natri trong hóa học
1. Xác định công thức hóa học:
-
Dự đoán công thức: Biết số oxi hóa của Na (+1) và của các nguyên tố khác, ta có thể dự đoán công thức hóa học của hợp chất. Ví dụ: Trong NaCl, Na có số oxi hóa +1, Cl có số oxi hóa -1, nên công thức là NaCl.
-
Kiểm tra công thức: Số oxi hóa giúp kiểm tra lại công thức hóa học có đúng hay không. Tổng số oxi hóa của các nguyên tử trong một phân tử phải bằng 0.
2. Cân bằng phương trình hóa học:
-
Xác định sự thay đổi số oxi hóa: Trong các phản ứng oxi hóa khử, số oxi hóa của các nguyên tố thay đổi. Việc xác định sự thay đổi này giúp cân bằng phương trình.
-
Viết quá trình nhường nhận electron: Số oxi hóa giúp viết các quá trình nhường nhận electron, từ đó cân bằng phương trình.
3. Dự đoán tính chất hóa học:
-
Tính chất của hợp chất: Số oxi hóa giúp dự đoán tính chất hóa học của hợp chất. Ví dụ, các hợp chất của Na thường có tính base yếu.
-
Khả năng phản ứng: Số oxi hóa giúp dự đoán khả năng phản ứng của các chất.
4. Xác định vai trò của nguyên tố trong phản ứng:
-
Chất oxi hóa, chất khử: Số oxi hóa giúp xác định chất nào là chất oxi hóa, chất nào là chất khử trong phản ứng.
-
Sự thay đổi vai trò: Số oxi hóa giúp theo dõi sự thay đổi vai trò của nguyên tố trong quá trình phản ứng.
5. Nghiên cứu cấu tạo phân tử:
Qua bài viết trên của Đông Á Chemical chúng ta đã khám phá thêm về số oxi hóa của Na, sẽ cảm nhận được rằng nó không đơn thuần chỉ là một số liệu, mà là một phần không thể thiếu trong bức tranh tổng thể của hóa học. Sự hiểu biết về số oxi hóa của natri mang lại cái nhìn sâu sắc và thực tiễn về cách mà các nguyên tố tương tác và ảnh hưởng đến thế giới xung quanh chúng ta.