Phản ứng trao đổi là một trong những phản ứng hóa học phổ biến nhất trong tự nhiên và trong cuộc sống hàng ngày. Đây là loại phản ứng xảy ra khi hai hợp chất hóa học tham gia vào quá trình hoán đổi các phần tử cấu tạo của chúng, tạo ra các sản phẩm mới mà không làm thay đổi chỉ số oxi hóa của các nguyên tố. Để hiểu rõ hơn về loại phản ứng này, hãy cùng hóa chất Đông Á làm rõ phản ứng trao đổi là gì, các yếu tố ảnh hưởng, cũng như phương trình tổng quát của phản ứng trao đổi.
Tìm hiểu phản ứng trao đổi là gì?
Phản ứng trao đổi là một loại phản ứng hóa học đặc trưng bởi sự "đổi chỗ" các thành phần cấu tạo giữa các chất tham gia phản ứng để tạo ra các chất mới. Nói cách khác, các nguyên tử hoặc nhóm nguyên tử trong các hợp chất ban đầu sẽ kết hợp lại với nhau theo một cách khác.
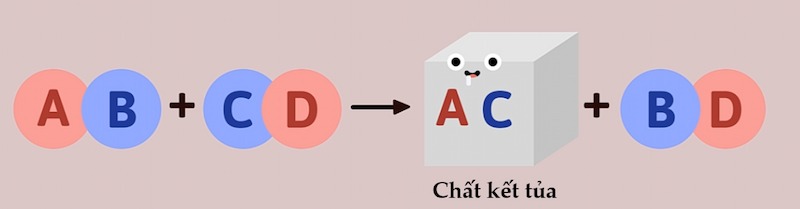
Tìm hiểu phản ứng trao đổi là gì?
Ví dụ:
Đặc điểm chung:
Điều kiện xảy ra phản ứng trao đổi
Để một phản ứng trao đổi xảy ra, thường có một trong các điều kiện sau:
-
Tạo thành chất kết tủa: Sản phẩm tạo thành có ít nhất một chất không tan trong nước (ví dụ: AgCl, Cu(OH)₂).
-
Tạo thành chất khí: Sản phẩm tạo thành có ít nhất một chất khí thoát ra khỏi dung dịch (ví dụ: CO₂, H₂S).
-
Tạo thành chất điện li yếu: Sản phẩm tạo thành có ít nhất một chất điện li yếu (ví dụ: nước trong phản ứng trung hòa).
Các yếu tố ảnh hưởng đến tốc độ phản ứng trao đổi
Tốc độ của một phản ứng trao đổi phụ thuộc vào nhiều yếu tố, bao gồm:
-
Nồng độ chất tham gia: Nồng độ càng lớn, tốc độ phản ứng càng nhanh.
-
Nhiệt độ: Nâng cao nhiệt độ thường làm tăng tốc độ phản ứng.
-
Áp suất: Đối với các chất khí, tăng áp suất sẽ làm tăng tốc độ phản ứng.
-
Diện tích tiếp xúc: Chất rắn có diện tích tiếp xúc càng lớn, phản ứng càng diễn ra nhanh.
-
Chất xúc tác: Chất xúc tác làm tăng tốc độ phản ứng mà bản thân nó không bị biến đổi về lượng.
Phương trình tổng quát của phản ứng trao đổi
Một phương trình tổng quát cho phản ứng trao đổi giữa hai hợp chất AB và CD có thể viết như sau:
AB + CD → AD + CB
Trong đó:
Lưu ý: Đây chỉ là một dạng tổng quát, các phản ứng trao đổi cụ thể có thể phức tạp hơn.
Các loại phản ứng trao đổi
Phản ứng trao đổi là một loại phản ứng hóa học phổ biến, trong đó các ion của các chất tham gia đổi chỗ cho nhau để tạo thành các chất mới. Dựa vào bản chất của các chất tham gia và sản phẩm tạo thành, ta có thể phân loại phản ứng trao đổi thành các loại sau:
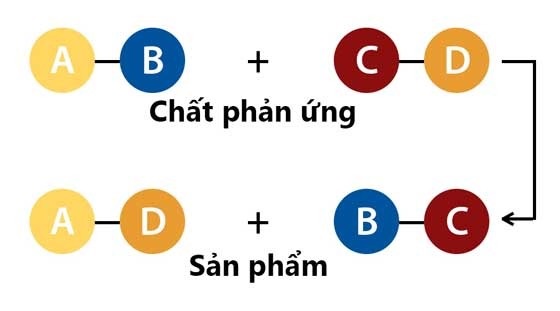
Có nhiều loại phản ứng trao đổi khác nhau
1. Phản ứng giữa axit và bazơ (Phản ứng trung hòa)
Đây là loại phản ứng trao đổi quen thuộc nhất. Khi axit tác dụng với bazơ, chúng sẽ tạo ra muối và nước.
2. Phản ứng giữa axit và muối
Điều kiện để phản ứng xảy ra là axit tạo thành phải yếu hơn axit ban đầu hoặc tạo thành chất kết tủa.
3. Phản ứng giữa bazơ và muối
Điều kiện để phản ứng xảy ra là bazơ tạo thành phải yếu hơn bazơ ban đầu hoặc tạo thành chất kết tủa.
4. Phản ứng giữa các muối
Điều kiện để phản ứng xảy ra là sản phẩm tạo thành có ít nhất một chất kết tủa.
Phương pháp nhận biết các loại phản ứng trao đổi
Để nhận biết một phản ứng có phải là phản ứng trao đổi hay không, và xác định loại phản ứng trao đổi đó, ta cần dựa vào các dấu hiệu đặc trưng sau:
Dựa vào một số yếu tố có thể xác định được phản ứng trao đổi
1. Kiểm tra sự thay đổi số oxi hóa:
2. Xác định sản phẩm tạo thành:
-
Kết tủa: Nếu sản phẩm tạo thành có chất kết tủa, đó thường là phản ứng trao đổi giữa muối và muối, hoặc giữa axit và muối.
-
Khí: Nếu có chất khí thoát ra, đó thường là phản ứng giữa axit và muối, hoặc giữa bazơ và muối.
-
Chất điện li yếu: Nếu sản phẩm tạo thành có chất điện li yếu (thường là nước), đó là phản ứng trung hòa.
3. Phân loại dựa vào bản chất của chất tham gia:
-
Axit và bazơ: Phản ứng trung hòa.
-
Axit và muối: Kiểm tra xem sản phẩm có tạo thành axit yếu hơn hay chất kết tủa không.
-
Bazơ và muối: Kiểm tra xem sản phẩm có tạo thành bazơ yếu hơn hay chất kết tủa không.
-
Muối và muối: Kiểm tra xem sản phẩm có tạo thành chất kết tủa không.
Ví dụ:
Lưu ý:
-
Một số phản ứng có thể kết hợp nhiều loại: Ví dụ, một phản ứng có thể vừa tạo kết tủa vừa tạo khí.
-
Để xác định chính xác loại phản ứng, cần viết đúng phương trình hóa học và cân bằng phương trình.
Bảng tóm tắt:
|
Loại phản ứng
|
Điều kiện
|
Ví dụ
|
|
Trung hòa
|
Axit + Bazơ → Muối + Nước
|
HCl + NaOH → NaCl + H₂O
|
|
Giữa axit và muối
|
Tạo muối mới và axit mới yếu hơn hoặc kết tủa
|
H₂SO₄ + BaCl₂ → BaSO₄↓ + 2HCl
|
|
Giữa bazơ và muối
|
Tạo muối mới và bazơ mới yếu hơn hoặc kết tủa
|
2NaOH + CuSO₄ → Na₂SO₄ + Cu(OH)₂↓
|
|
Giữa các muối
|
Tạo ít nhất 1 chất kết tủa
|
AgNO₃ + NaCl → AgCl↓ + NaNO₃
|
Để nhận biết các loại phản ứng trao đổi, bạn cần quan sát kỹ các chất tham gia và sản phẩm tạo thành, kiểm tra sự thay đổi số oxi hóa và dựa vào các điều kiện đặc trưng của từng loại phản ứng.
Phương trình hóa học của phản ứng trao đổi
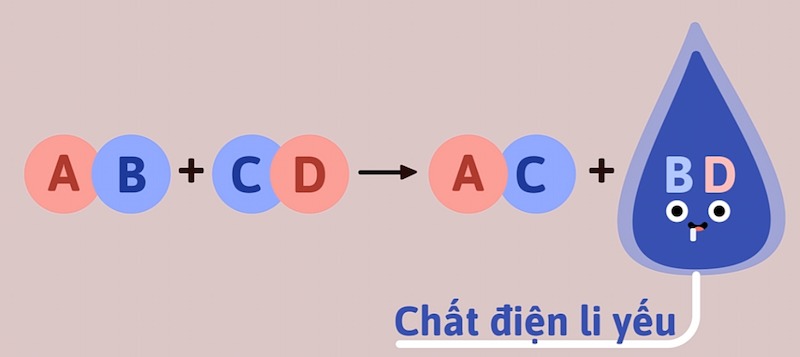
Phương trình hóa học của phản ứng trao đổi
Phương trình hóa học là cách biểu diễn ngắn gọn, trực quan nhất một phản ứng hóa học. Đối với phản ứng trao đổi, phương trình thường được viết dưới dạng:
AB + CD → AD + CB
Trong đó:
-
A, B, C, D: Là các nguyên tử hoặc nhóm nguyên tử.
-
Mũi tên →: Chỉ chiều diễn ra của phản ứng.
Ý nghĩa của phương trình:
-
Chất phản ứng: AB và CD là các chất tham gia phản ứng.
-
Chất sản phẩm: AD và CB là các chất mới sinh ra sau phản ứng.
-
Sự bảo toàn nguyên tử: Số lượng và loại nguyên tử ở hai vế của phương trình phải bằng nhau.
Ví dụ:
-
Phản ứng trung hòa: HCl + NaOH → NaCl + H₂O
-
Phản ứng tạo kết tủa: AgNO₃ + NaCl → AgCl↓ + NaNO₃
-
Phản ứng tạo khí: Na₂CO₃ + 2HCl → 2NaCl + H₂O + CO₂↑
Lưu ý:
Cách viết phương trình hóa học:
-
Viết công thức hóa học của các chất tham gia và sản phẩm.
-
Cân bằng phương trình: Điều chỉnh hệ số trước các công thức hóa học sao cho số nguyên tử của mỗi nguyên tố ở hai vế bằng nhau.
Ví dụ về cách cân bằng phương trình:
Cân bằng phương trình: FeCl₃ + NaOH → Fe(OH)₃↓ + NaCl
-
Bước 1: Đếm số nguyên tử mỗi nguyên tố ở hai vế.
-
Bước 2: Điều chỉnh hệ số trước Fe(OH)₃ thành 1 để cân bằng Fe.
-
Bước 3: Điều chỉnh hệ số trước NaCl thành 3 để cân bằng Cl.
-
Bước 4: Điều chỉnh hệ số trước NaOH thành 3 để cân bằng Na và OH.
Phương trình cân bằng: FeCl₃ + 3NaOH → Fe(OH)₃↓ + 3NaCl
Ứng dụng của phản ứng trao đổi trong đời sống
Phản ứng trao đổi, một trong những loại phản ứng hóa học phổ biến nhất, đóng vai trò quan trọng trong nhiều lĩnh vực của cuộc sống. Dưới đây là một số ứng dụng điển hình:
1. Sản xuất muối:
-
Nguyên lý: Nhiều loại muối được sản xuất bằng cách cho axit tác dụng với bazơ hoặc cho muối này tác dụng với muối khác.
-
Ví dụ: Sản xuất muối ăn NaCl từ phản ứng giữa axit clohiđric HCl và natri hiđroxit NaOH.
2. Điều chế bazơ không tan:
-
Nguyên lý: Bazơ không tan thường được điều chế bằng cách cho muối của kim loại đó tác dụng với một bazơ tan.
-
Ví dụ: Điều chế đồng(II) hiđroxit Cu(OH)₂ bằng cách cho dung dịch natri hiđroxit NaOH tác dụng với dung dịch đồng(II) sunfat CuSO₄.
3. Xử lý nước thải:
-
Nguyên lý: Các ion kim loại nặng trong nước thải có thể được loại bỏ bằng cách tạo kết tủa với các ion khác.
-
Ví dụ: Loại bỏ ion chì Pb²⁺ trong nước thải bằng cách cho tác dụng với dung dịch natri sunfat Na₂SO₄ để tạo kết tủa chì sunfat PbSO₄.
4. Sản xuất hóa chất:
5. Công nghiệp thực phẩm:
-
Nguyên lý: Một số quá trình chế biến thực phẩm liên quan đến các phản ứng trao đổi.
-
Ví dụ: Sản xuất phô mai, sữa chua, quá trình lên men.
6. Y tế:
-
Nguyên lý: Nhiều loại thuốc được sản xuất dựa trên các phản ứng trao đổi.
-
Ví dụ: Sản xuất aspirin, paracetamol.
7. Sinh học:
-
Nguyên lý: Các phản ứng trao đổi đóng vai trò quan trọng trong các quá trình sinh học như tiêu hóa, hô hấp.
-
Ví dụ: Quá trình tiêu hóa thức ăn trong cơ thể người.
Kết thúc bài viết trên của hóa chất Đông Á, chúng ta không chỉ thấy rõ được định nghĩa phản ứng trao đổi là gì và quy trình của phản ứng trao đổi mà còn hiểu rõ hơn về tầm quan trọng và ứng dụng của nó trong đời sống. Ngành hóa học nói chung và các phản ứng hóa học nói riêng, đặc biệt là phản ứng trao đổi, vẫn tiếp tục mở ra những cánh cửa mới cho kiến thức và công nghệ. Việc thấu hiểu sâu sắc về chúng sẽ giúp cho chúng ta tối ưu hóa các quy trình hóa học không chỉ trong nghiên cứu mà còn trong thực tiễn sống hàng ngày, qua đó góp phần nâng cao chất lượng cuộc sống.