Phản ứng oxi hóa khử, còn được biết đến như phản ứng redox, là một trong những phản ứng hóa học quan trọng nhất trong tự nhiên và công nghiệp. Không chỉ diễn ra trong các quá trình sinh học, phản ứng này còn đóng vai trò chủ chốt trong nhiều ứng dụng thực tiễn, từ sản xuất năng lượng đến các phản ứng hóa học phức tạp. Hiểu rõ về phản ứng oxi hóa khử là gì không chỉ giúp chúng ta giải thích được các hiện tượng xung quanh mà còn mở ra hướng nghiên cứu mới trong lĩnh vực hóa học. Hãy cùng Đông Á Chemical tìm hiểu chi tiết về loại phản ứng này các bạn nhé!
Định nghĩa phản ứng oxi hóa khử là gì?
Phản ứng oxi hóa khử là một loại phản ứng hóa học đặc trưng bởi sự trao đổi electron giữa các chất tham gia phản ứng. Trong quá trình này, một chất sẽ nhường electron (bị oxi hóa) và một chất khác sẽ nhận electron (bị khử).
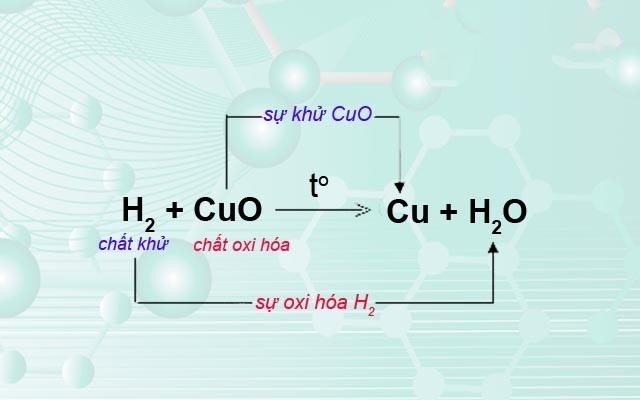
Minh họa về phản ứng oxi hóa-khử
Khái niệm về sự oxi hóa và chất oxi hóa
-
Sự oxi hóa: Là quá trình một chất nhường electron.
-
Chất oxi hóa: Là chất nhận electron, gây ra sự oxi hóa cho chất khác.
Ví dụ: Trong phản ứng: 2Mg + O₂ → 2MgO
-
Magie (Mg) nhường electron, số oxi hóa tăng từ 0 lên +2 → bị oxi hóa.
-
Oxi (O₂) nhận electron, số oxi hóa giảm từ 0 xuống -2 → là chất oxi hóa.
Khái niệm về sự khử và chất khử
-
Sự khử: Là quá trình một chất nhận electron.
-
Chất khử: Là chất nhường electron, gây ra sự khử cho chất khác.
Ví dụ: Tiếp tục với phản ứng trên:
Đặc điểm chính của phản ứng oxi hóa khử
-
Sự thay đổi số oxi hóa: Đây là dấu hiệu rõ ràng nhất của phản ứng oxi hóa khử. Chất bị oxi hóa sẽ tăng số oxi hóa, còn chất bị khử sẽ giảm số oxi hóa.
-
Sự trao đổi electron: Quá trình oxi hóa và khử luôn xảy ra đồng thời. Chất nào nhường electron thì chất đó sẽ bị oxi hóa, và ngược lại.
-
Sự bảo toàn điện tích: Tổng số electron nhường bằng tổng số electron nhận.
Phân loại phản ứng oxi hóa khử
Phản ứng oxi hóa khử là một loại phản ứng hóa học rất đa dạng. Dựa vào nhiều tiêu chí khác nhau, ta có thể phân loại các phản ứng này thành nhiều loại. Dưới đây là một số cách phân loại phổ biến:
Có thể phân phản ứng oxi hóa-khử thành nhiều loại khác nhau
1. Dựa vào sự thay đổi số oxi hóa của một nguyên tố
-
Phản ứng tự oxi hóa khử: Trong phản ứng này, một nguyên tố trong cùng một chất vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa.
Ví dụ: KClO₃ → KCl + O₂
-
Phản ứng oxi hóa khử nội phân tử: Trong một phân tử, các nguyên tử của cùng một nguyên tố có số oxi hóa khác nhau, và trong phản ứng, chúng trao đổi electron cho nhau.
Ví dụ: NH₄NO₂ → N₂ + 2H₂O
2. Dựa vào môi trường phản ứng
-
Phản ứng oxi hóa khử trong môi trường axit: Thường xảy ra trong dung dịch axit.
-
Phản ứng oxi hóa khử trong môi trường kiềm: Thường xảy ra trong dung dịch kiềm.
-
Phản ứng oxi hóa khử trong môi trường trung tính: Xảy ra trong môi trường không có tính axit cũng không có tính kiềm.
3. Dựa vào bản chất của chất tham gia phản ứng
Ví dụ: 2Mg + O₂ → 2MgO
Ví dụ: 2KMnO₄ + 16HCl → 2KCl + 2MnCl₂ + 5Cl₂ + 8H₂O
4. Dựa vào vai trò của các chất tham gia
-
Phản ứng thế: Một nguyên tố có hoạt động hóa học mạnh hơn đẩy nguyên tố khác ra khỏi hợp chất.
-
Phản ứng phân hủy: Một chất phân hủy thành hai hoặc nhiều chất mới.
-
Phản ứng hóa hợp: Hai hay nhiều chất kết hợp với nhau tạo thành một chất mới.
-
Phản ứng trao đổi: Các nguyên tử hoặc nhóm nguyên tử trong các hợp chất ban đầu sẽ kết hợp lại với nhau theo một cách khác.
Lưu ý: Một phản ứng oxi hóa khử có thể thuộc nhiều loại phân loại khác nhau.
Dấu hiệu nhận biết phản ứng oxi hóa khử
Phản ứng oxi hóa khử là một trong những loại phản ứng hóa học phổ biến và quan trọng. Để nhận biết một phản ứng có phải là phản ứng oxi hóa khử hay không, chúng ta cần dựa vào các dấu hiệu đặc trưng sau:

Dấu hiệu nhận biết phản ứng oxi hóa khử
1. Sự thay đổi số oxi hóa:
Đây là dấu hiệu rõ ràng nhất để nhận biết một phản ứng oxi hóa khử. Trong một phản ứng oxi hóa khử, luôn có ít nhất một nguyên tố thay đổi số oxi hóa.
Ví dụ: Trong phản ứng: 2Mg + O₂ → 2MgO
2. Sự có mặt của các chất oxi hóa mạnh hoặc chất khử mạnh:
-
Chất oxi hóa mạnh: Là chất dễ nhận electron, thường là các phi kim hoạt động (O₂, F₂, Cl₂,...), các axit có tính oxi hóa mạnh (HNO₃, H₂SO₄ đặc,...), các muối có chứa ion kim loại ở mức oxi hóa cao (KMnO₄, K₂Cr₂O₇,...).
-
Chất khử mạnh: Là chất dễ nhường electron, thường là các kim loại hoạt động (Na, K, Ca,...), các ion kim loại ở mức oxi hóa thấp (Fe²⁺,...), một số phi kim (C, H₂,...).
3. Sự xuất hiện các hiện tượng đặc trưng:
-
Thay đổi màu sắc: Nhiều phản ứng oxi hóa khử đi kèm với sự thay đổi màu sắc của dung dịch.
-
Tạo khí: Nhiều phản ứng tạo ra khí, đặc biệt là khí H₂, O₂, Cl₂.
-
Tạo kết tủa: Một số phản ứng tạo ra chất kết tủa.
Ví dụ: Phản ứng giữa dung dịch KMnO₄ (màu tím) và dung dịch FeSO₄ (màu xanh nhạt) tạo thành dung dịch có màu vàng nâu, chứng tỏ đã xảy ra phản ứng oxi hóa khử.
4. Sự tham gia của các chất có tính oxi hóa hoặc khử:
Nếu trong phản ứng có sự tham gia của các chất có tính oxi hóa hoặc khử mạnh, rất có thể đó là phản ứng oxi hóa khử.
5. Các phương trình ion rút gọn:
Trong các phương trình ion rút gọn của phản ứng oxi hóa khử, thường xuất hiện các electron nhường hoặc nhận.
Lưu ý: Không phải tất cả các phản ứng có sự thay đổi màu sắc, tạo khí hay kết tủa đều là phản ứng oxi hóa khử. Để khẳng định một phản ứng có phải là phản ứng oxi hóa khử hay không, cách chính xác nhất là xác định sự thay đổi số oxi hóa của các nguyên tố.
Vai trò của phản ứng oxi hóa khử là gì?
Phản ứng oxi hóa khử đóng vai trò vô cùng quan trọng trong đời sống và sản xuất. Nó là nền tảng của nhiều quá trình tự nhiên và công nghiệp. Dưới đây là một số vai trò chính của phản ứng oxi hóa khử:
Trong tự nhiên
-
Quá trình hô hấp: Quá trình hô hấp của sinh vật là một chuỗi các phản ứng oxi hóa khử, cung cấp năng lượng cho cơ thể.
-
Quá trình quang hợp: Cây xanh sử dụng năng lượng ánh sáng để tổng hợp chất hữu cơ từ CO₂ và H₂O, đây cũng là một quá trình oxi hóa khử phức tạp.
-
Sự gỉ sét: Quá trình kim loại bị oxi hóa bởi oxi trong không khí tạo thành gỉ sét.
-
Sự cháy: Quá trình đốt cháy nhiên liệu là một phản ứng oxi hóa khử tỏa nhiều nhiệt.
Trong công nghiệp
-
Luyện kim: Quá trình khử các oxit kim loại để thu được kim loại tinh khiết.
-
Sản xuất hóa chất: Nhiều hóa chất được sản xuất thông qua các phản ứng oxi hóa khử, ví dụ như sản xuất axit sunfuric, amoniac,...
-
Pin và ắc quy: Hoạt động dựa trên các phản ứng oxi hóa khử để chuyển hóa năng lượng hóa học thành điện năng.
-
Điện phân: Sử dụng dòng điện để thực hiện các phản ứng oxi hóa khử, ví dụ như điện phân nước để sản xuất hydro và oxi, điện phân muối ăn để sản xuất clo.
-
Mạ điện: Quá trình tạo một lớp kim loại mỏng trên bề mặt một vật khác bằng cách sử dụng dòng điện một chiều để khử các ion kim loại.
Trong đời sống
-
Đốt nhiên liệu: Đốt các loại nhiên liệu như xăng, dầu, khí gas để cung cấp năng lượng cho các hoạt động sinh hoạt và sản xuất.
-
Bảo quản thực phẩm: Một số phương pháp bảo quản thực phẩm dựa trên nguyên tắc oxi hóa khử như đóng hộp, hút chân không.
-
Xử lý nước thải: Sử dụng các chất oxi hóa để khử trùng và loại bỏ các chất hữu cơ trong nước thải.
Một số yêu cầu về phương trình phản ứng oxi hóa khử
Phản ứng oxi hóa khử là một loại phản ứng hóa học đặc trưng bởi sự trao đổi electron giữa các chất tham gia phản ứng. Để biểu diễn một cách chính xác và đầy đủ các phản ứng này, chúng ta sử dụng phương trình hóa học.

Phương trình hóa học của phản ứng oxi hóa-khử cần được cân bằng dựa theo số oxi hóa của từng chất
Cấu tạo của một phương trình hóa học
Một phương trình hóa học bao gồm:
-
Các chất phản ứng: Các chất tham gia vào phản ứng.
-
Mũi tên phản ứng: Chỉ chiều diễn ra của phản ứng.
-
Các chất sản phẩm: Các chất tạo thành sau phản ứng.
-
Hệ số: Các số viết trước công thức hóa học của các chất để cân bằng số nguyên tử của mỗi nguyên tố.
Cân bằng phương trình hóa học
Để một phương trình hóa học được coi là đúng, nó phải thỏa mãn định luật bảo toàn khối lượng, tức là tổng khối lượng của các chất tham gia phản ứng bằng tổng khối lượng của các chất sản phẩm. Để đạt được điều này, chúng ta cần cân bằng phương trình hóa học.
Các phương pháp cân bằng:
Ví dụ:
Phản ứng: Sắt tác dụng với oxi tạo thành sắt từ oxit
Ý nghĩa của phương trình hóa học
-
Biểu diễn quá trình phản ứng: Cho biết các chất tham gia và sản phẩm của phản ứng.
-
Tỉ lệ phản ứng: Cho biết tỉ lệ số phân tử hoặc số mol của các chất tham gia và sản phẩm.
-
Tính toán: Dựa vào phương trình hóa học, ta có thể tính toán được khối lượng, thể tích của các chất tham gia và sản phẩm.
Các ví dụ cụ thể về phản ứng oxi hóa khử trong đời sống
Phản ứng oxi hóa khử diễn ra xung quanh chúng ta hàng ngày, thậm chí trong chính cơ thể chúng ta. Dưới đây là một số ví dụ cụ thể:
Trong tự nhiên
-
Quá trình hô hấp: Khi chúng ta hít thở, oxy trong không khí kết hợp với các chất trong tế bào để tạo ra năng lượng. Đây là một phản ứng oxi hóa khử phức tạp.
-
Quá trình quang hợp: Cây xanh sử dụng ánh sáng mặt trời để chuyển đổi nước và carbon dioxide thành glucose và oxy. Đây là một ví dụ điển hình về phản ứng oxi hóa khử.
-
Sự gỉ sét: Sắt tiếp xúc với không khí và nước tạo thành lớp gỉ màu nâu đỏ. Đây là quá trình sắt bị oxi hóa.
-
Sự cháy: Khi đốt cháy nhiên liệu như gỗ, than, xăng, các chất trong nhiên liệu kết hợp với oxy tạo ra nhiệt và ánh sáng.
Trong công nghiệp
-
Luyện kim: Quá trình khử các oxit kim loại bằng carbon để thu được kim loại tinh khiết. Ví dụ:
-
Sản xuất axit sulfuric: Quá trình sản xuất axit sulfuric liên quan đến nhiều phản ứng oxi hóa khử phức tạp.
-
Sản xuất nhôm: Điện phân nhôm oxit để thu được nhôm kim loại.
-
Pin và ắc quy: Các phản ứng oxi hóa khử cung cấp năng lượng cho pin và ắc quy.
Trong đời sống hàng ngày
-
Đốt nến: Sáp nến cháy trong không khí tạo ra ánh sáng và nhiệt.
-
Trái cây bị thâm: Khi cắt trái cây, phần tiếp xúc với không khí bị oxi hóa làm đổi màu.
-
Tẩy trắng quần áo: Các chất tẩy trắng thường chứa các chất có tính oxi hóa mạnh, giúp loại bỏ các vết bẩn.
-
Mạ điện: Quá trình mạ một lớp kim loại lên bề mặt kim loại khác bằng cách sử dụng dòng điện để khử các ion kim loại.
Các ví dụ khác
-
Phản ứng nổ: Nhiều vụ nổ là kết quả của các phản ứng oxi hóa khử xảy ra nhanh chóng và tỏa nhiều nhiệt.
-
Phản ứng phân hủy: Nhiều chất phân hủy khi đun nóng, tạo ra các chất mới. Đây thường là các phản ứng oxi hóa khử.
Phản ứng oxi hóa khử là một phần không thể thiếu trong hóa học, sinh học, công nghiệp và cuộc sống hằng ngày của chúng ta. Từ hô hấp đến sản xuất hóa chất, những phản ứng này tạo ra nền tảng cho sự sống và hiện tượng xung quanh. Qua việc hiểu rõ phản ứng oxi hóa khử là gì và nghiên cứu các cơ chế này, chúng ta có thể tối ưu hóa các quy trình tự nhiên, đồng thời ứng dụng vào khoa học công nghệ và bảo vệ môi trường. Ngoài phản ứng này, thế giới hóa học còn rất nhiều loại phản ứng khác vô cùng thú vị, để tìm hiểu thêm các bạn có thể truy cập website dongachem.vn tại phần tin tức để khám phá nhé!