Phản ứng hóa hợp, còn được biết đến với cái tên phản ứng tổng hợp, đóng vai trò nền tảng trong hóa học, giúp giải thích cơ sở của việc hình thành các hợp chất mới. Khi hai hoặc nhiều chất tham gia phản ứng kết hợp lại với nhau, sản phẩm cuối cùng tạo ra không chỉ có cấu trúc và tính chất độc đáo mà còn thường thể hiện những ứng dụng thiết thực trong cuộc sống. Nội dung bài viết này của Đông Á Chemical sẽ khám phá rõ hơn về phản ứng hóa hợp qua các đặc điểm chính, phân loại, ví dụ cụ thể cũng như những ứng dụng trong đời sống.
Định nghĩa và đặc điểm của phản ứng hóa hợp
Phản ứng hóa hợp là một loại phản ứng hóa học trong đó hai hay nhiều chất ban đầu kết hợp với nhau tạo thành một chất mới. Nói cách khác, các chất tham gia "hợp" lại với nhau để tạo ra một sản phẩm duy nhất.

Định nghĩa và đặc điểm của phản ứng hóa hợp
Đặc điểm chính của phản ứng hóa hợp:
-
Số lượng chất sản phẩm ít hơn số lượng chất tham gia.
-
Thường có sự tỏa nhiệt hoặc hấp thụ nhiệt.
-
Một chất mới được tạo thành với tính chất khác biệt so với các chất ban đầu.
Phân loại phản ứng hóa hợp (dựa trên tính chất của chất tham gia):
-
Phản ứng của kim loại với phi kim:
-
Phản ứng của oxit bazơ với nước:
-
Phản ứng của oxit axit với nước:
-
Phản ứng của một số phi kim với nhau:
Ví dụ cụ thể về phản ứng hóa hợp:
-
Trong tự nhiên:
-
Trong công nghiệp:
-
Trong đời sống:
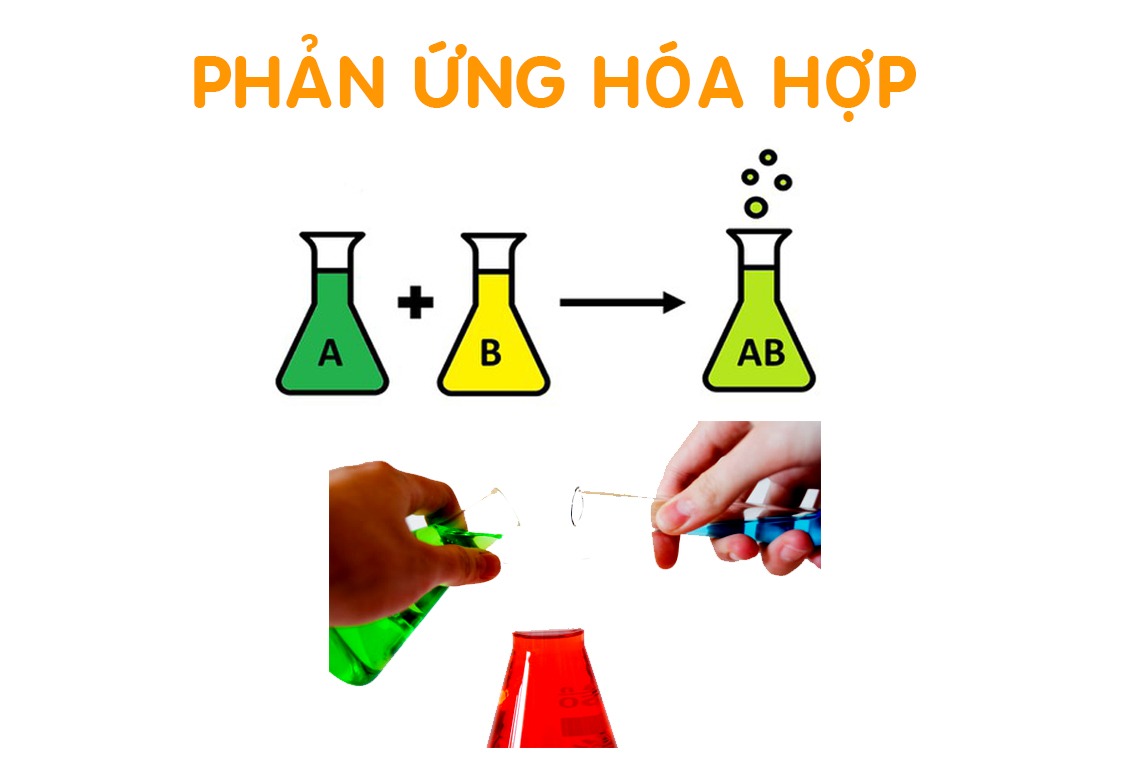
Sơ đồ tổng quát phản ứng hóa hợp:
A + B → AB
Trong đó:
Tại sao phản ứng hóa hợp lại thường tỏa nhiệt?
Phản ứng hóa hợp thường tỏa nhiệt là do sự hình thành các liên kết hóa học mới giữa các nguyên tử. Khi các nguyên tử kết hợp với nhau để tạo thành phân tử, chúng đạt được trạng thái ổn định hơn, nghĩa là năng lượng của hệ thống giảm đi. Sự giảm năng lượng này thường được giải phóng ra dưới dạng nhiệt.
Tại sao phản ứng hóa hợp lại thường tỏa nhiệt?
Để hiểu rõ hơn, chúng ta hãy hình dung các liên kết hóa học như những sợi dây. Khi các sợi dây này được kết nối với nhau, chúng tạo thành một cấu trúc vững chắc hơn. Quá trình kết nối này giải phóng năng lượng, tương tự như khi ta buộc chặt một sợi dây, ta sẽ cảm thấy hơi ấm tỏa ra.
Một cách giải thích khác:
-
Năng lượng liên kết: Khi các nguyên tử liên kết với nhau, chúng tạo thành các liên kết hóa học. Để phá vỡ các liên kết này, cần cung cấp năng lượng. Ngược lại, khi hình thành liên kết, năng lượng sẽ được giải phóng.
-
Trạng thái ổn định: Các nguyên tử luôn có xu hướng đạt đến trạng thái ổn định, có nghĩa là trạng thái có năng lượng thấp nhất. Khi các nguyên tử kết hợp với nhau để tạo thành phân tử, chúng đạt được trạng thái ổn định hơn, do đó giải phóng năng lượng.
Ví dụ:
-
Phản ứng đốt cháy: Khi đốt cháy một que diêm, gỗ kết hợp với oxy trong không khí tạo thành carbon dioxide và nước. Phản ứng này tỏa ra rất nhiều nhiệt và ánh sáng.
-
Phản ứng trung hòa: Khi axit tác dụng với bazơ, chúng tạo thành muối và nước. Phản ứng này cũng tỏa nhiệt.
Tuy nhiên, không phải tất cả các phản ứng hóa hợp đều tỏa nhiệt. Một số phản ứng hóa hợp có thể thu nhiệt, nghĩa là chúng cần hấp thụ năng lượng từ môi trường xung quanh để xảy ra.
Làm thế nào để nhận biết một phản ứng là phản ứng hóa hợp?
Để xác định một phản ứng hóa học có phải là phản ứng hóa hợp hay không, bạn cần chú ý đến các đặc điểm sau:
Đặc điểm của phản ứng hóa hợp:
-
Số lượng chất tham gia và sản phẩm: Phản ứng hóa hợp thường có nhiều hơn một chất tham gia phản ứng nhưng chỉ tạo ra một chất sản phẩm duy nhất.
-
Sự tạo thành chất mới: Chất sản phẩm hình thành có tính chất hoàn toàn khác biệt so với các chất ban đầu.
-
Thường có sự thay đổi về trạng thái: Phản ứng có thể kèm theo các hiện tượng như:
-
Tỏa nhiệt: Nhiệt độ tăng lên.
-
Hấp thụ nhiệt: Nhiệt độ giảm xuống.
-
Tạo kết tủa: Chất rắn không tan lắng xuống đáy ống nghiệm.
-
Tạo khí: Có bọt khí thoát ra.
-
Thay đổi màu sắc: Màu sắc của dung dịch thay đổi.
Công thức tổng quát của phản ứng hóa hợp:
A + B → AB
Trong đó:
Ví dụ:
Cách nhận biết nhanh:
-
Đếm số chất tham gia và sản phẩm: Nếu có nhiều hơn một chất tham gia và chỉ có một chất sản phẩm thì rất có thể là phản ứng hóa hợp.
-
Kiểm tra tính chất của chất sản phẩm: Nếu chất sản phẩm có tính chất hoàn toàn khác biệt so với các chất ban đầu thì đó là dấu hiệu của phản ứng hóa hợp.
Lưu ý:
-
Không phải tất cả các phản ứng hóa hợp đều có các hiện tượng rõ ràng như trên. Có những phản ứng diễn ra rất chậm hoặc không có hiện tượng gì đặc biệt.
-
Để xác định chính xác một phản ứng có phải là phản ứng hóa hợp hay không, cần dựa vào kiến thức về tính chất hóa học của các chất tham gia và sản phẩm.
Ứng dụng của phản ứng hóa hợp trong đời sống
Phản ứng hóa hợp, với đặc trưng là sự kết hợp của hai hay nhiều chất tạo thành một chất mới, đóng vai trò vô cùng quan trọng trong nhiều lĩnh vực của cuộc sống. Dưới đây là một số ứng dụng điển hình:
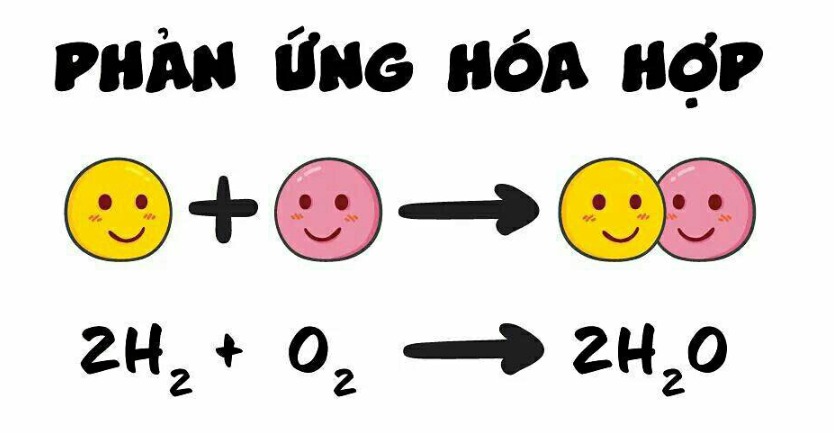
Phản ứng hóa hợp có nhiều ứng dụng trong cuộc sống
1. Sản xuất các hợp chất hóa học
-
Axit: Phản ứng giữa oxit axit và nước tạo ra axit. Ví dụ: SO₃ + H₂O → H₂SO₄ (Hình thành axit sulfuric)
-
Bazơ: Phản ứng giữa oxit bazơ và nước tạo ra bazơ. Ví dụ: CaO + H₂O → Ca(OH)₂ (Hình thành canxi hidroxit)
-
Muối: Nhiều muối được tạo thành từ phản ứng giữa axit và bazơ. Ví dụ: HCl + NaOH → NaCl + H₂O
-
Các hợp chất hữu cơ: Phản ứng trùng hợp và trùng ngưng là những ví dụ điển hình về phản ứng hóa hợp để tạo ra các hợp chất hữu cơ như nhựa, cao su,...
2. Sản xuất vật liệu xây dựng
-
Xi măng: Quá trình sản xuất xi măng liên quan đến nhiều phản ứng hóa hợp phức tạp.
-
Gạch, ngói: Quá trình nung đất sét cũng là một quá trình hóa hợp.
3. Sản xuất năng lượng
-
Đốt cháy nhiên liệu: Phản ứng đốt cháy các nhiên liệu hóa thạch như than, dầu, khí đốt là những phản ứng hóa hợp tỏa nhiều nhiệt.
-
Pin: Các phản ứng hóa học bên trong pin là những phản ứng hóa hợp cung cấp năng lượng điện.
4. Quá trình tự nhiên
-
Quang hợp: Quá trình cây xanh tổng hợp chất hữu cơ từ khí carbon dioxide và nước dưới tác dụng của ánh sáng mặt trời là một chuỗi các phản ứng hóa hợp phức tạp.
-
Sự hình thành khoáng sản: Nhiều khoáng sản được hình thành qua các phản ứng hóa hợp trong lòng đất.
5. Các ngành công nghiệp khác
-
Công nghiệp hóa chất: Sản xuất phân bón, thuốc trừ sâu, chất tẩy rửa,...
-
Công nghiệp thực phẩm: Sản xuất các loại thực phẩm chức năng, đồ uống,...
So sánh phản ứng hóa hợp với các loại phản ứng hóa học khác
Phản ứng hóa hợp là một trong những loại phản ứng hóa học cơ bản. Để hiểu rõ hơn về phản ứng hóa hợp, chúng ta sẽ so sánh nó với các loại phản ứng khác.
1. Phản ứng hóa hợp và phản ứng phân hủy
2. Phản ứng hóa hợp và phản ứng thế
3. Phản ứng hóa hợp và phản ứng trao đổi
4. Phản ứng hóa hợp và phản ứng oxi hóa khử
Bảng so sánh tóm tắt:
|
Đặc điểm
|
Phản ứng hóa hợp
|
Phản ứng phân hủy
|
Phản ứng thế
|
Phản ứng trao đổi
|
Phản ứng oxi hóa khử
|
|
Số lượng chất
|
Nhiều → ít
|
Ít → nhiều
|
-
|
-
|
-
|
|
Sự thay đổi
|
Kết hợp
|
Phân tách
|
Thay thế
|
Trao đổi
|
Thay đổi số oxi hóa
|
|
Ví dụ
|
2Mg + O₂ → 2MgO
|
2KClO₃ → 2KCl + 3O₂
|
Zn + 2HCl → ZnCl₂ + H₂
|
AgNO₃ + NaCl → AgCl↓ + NaNO₃
|
2Fe + 3Cl₂ → 2FeCl₃
|
Mỗi loại phản ứng hóa học có những đặc điểm riêng biệt. Phản ứng hóa hợp là một trong những loại phản ứng cơ bản, nhưng nó cũng có mối liên hệ chặt chẽ với các loại phản ứng khác. Việc hiểu rõ sự khác biệt giữa các loại phản ứng giúp chúng ta phân loại và giải thích các hiện tượng hóa học một cách chính xác hơn.
Qua bài viết trên của Đông Á Chemical có thể thấy phản ứng hóa hợp không chỉ là một khía cạnh hấp dẫn trong lĩnh vực hóa học mà còn chứa đựng nhiều ứng dụng thiết thực trong cuộc sống. Từ việc sản xuất hóa chất, thuốc chữa bệnh đến xử lý chất thải, phản ứng này luôn giữ vai trò quan trọng trong các quá trình tự nhiên và công nghiệp. Qua việc hiểu rõ các đặc điểm và phân loại của phản ứng hóa hợp, chúng ta có thể áp dụng kiến thức này để phát triển và cải thiện nhiều lĩnh vực khác nhau. Chính vì thế, việc nghiên cứu và tìm hiểu về phản ứng hóa hợp không chỉ giúp tăng cường kiến thức hóa học lý thuyết mà còn mang lại những đóng góp thiết thực cho cuộc sống hàng ngày và sự phát triển bền vững của xã hội.