Phân tử là một trong những khái niệm cơ bản và quan trọng nhất trong lĩnh vực hóa học và sinh học. Chúng không chỉ là một đơn vị cấu trúc hóa học mà còn là nền tảng cho sự sống và các quá trình sinh học. Việc hiểu rõ về phân tử là gì giúp chúng ta hiểu rõ hơn về thế giới xung quanh, từ tính chất vật lý, hóa học của các vật thể cho đến các quá trình sinh học phức tạp diễn ra trong cơ thể sống.
Khái niệm về phân tử
Phân tử là một nhóm trung hòa điện tích, gồm nhiều hơn 2 nguyên tử liên kết với nhau bằng các liên kết hóa học. Những liên kết này có thể là liên kết cộng hóa trị, liên kết ion hay liên kết kim loại, tùy thuộc vào loại nguyên tử tham gia. Mỗi phân tử thể hiện một cấu trúc độc đáo và có tính chất riêng biệt, nhờ vào sự kết hợp khác nhau giữa các loại nguyên tử. Nói cách khác, phân tử là hạt đại diện cho chất, gồm một số nguyên tử liên kết với nhau và thể hiện đầy đủ tính chất hóa học của chất đó.

Khái niệm về phân tử
Ví dụ, nước (H₂O) được cấu thành từ hai nguyên tử hydro và một nguyên tử oxy. Hình dạng của phân tử này tương tự như một "mũi tên" khi các nguyên tử được sắp xếp thành một góc nhất định, tạo ra các tính chất hóa học và vật lý đặc trưng cho nước. Bình thường, khi nghĩ về phân tử, chúng ta thường liên tưởng đến các chất rất đơn giản như oxy (O₂) hay nitơ (N₂). Tuy nhiên, phân tử cũng có thể rất phức tạp, như DNA, một phân tử cầu nối giữa các thế hệ và lưu giữ thông tin di truyền.
Đặc điểm của phân tử
Phân tử có nhiều đặc điểm nổi bật, ảnh hưởng sâu sắc đến tính chất và hành vi của chất mà chúng cấu tạo nên. Các đặc điểm này không chỉ đơn thuần là mô tả về cấu trúc mà còn liên quan đến cách phân tử tương tác với nhau và với môi trường xung quanh.
Cấu trúc và hình dạng
Cấu trúc của phân tử có thể rất đa dạng, từ hình cầu, hình trụ, đến các cấu trúc không gian phức tạp hơn. Cách mà các nguyên tử liên kết với nhau tạo ra hình dáng độc đáo giúp phân tử có những đặc tính hóa học riêng.
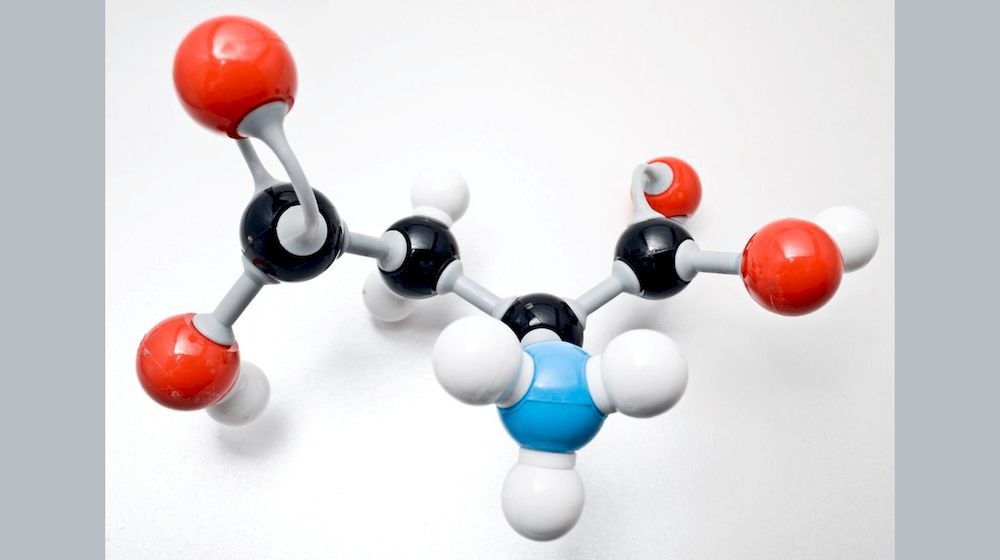
Cấu trúc và hình dạng của phân tử
Kích thước
Kích thước của phân tử rất nhỏ, nằm trong khoảng từ 0,1 nanomet đến vài nanomet. Điều này mang lại cho chúng khả năng xuyên thấu qua các màng khác nhau và tương tác với các chất khác trong quá trình phản ứng hóa học.
Trung hòa điện tích
Tổng điện tích dương của các hạt nhân bằng tổng điện tích âm của các electron, do đó phân tử không mang điện tích.
Cấu trúc bền vững
Cấu trúc của phân tử thường rất bền vững, cần một lượng năng lượng nhất định để phá vỡ các liên kết hóa học giữa các nguyên tử.
Tính chất hóa học
Tính chất hóa học của phân tử phụ thuộc vào các liên kết hóa học giữa các nguyên tử. Phân tử có thể dễ dàng tham gia vào các phản ứng hóa học, biến đổi thành các phân tử khác, phụ thuộc vào loại liên kết và môi trường xung quanh.
Tính chất vật lý
Các đặc điểm như trạng thái (rắn, lỏng, khí), độ hòa tan và độ dẫn điện đều có thể thay đổi tùy thuộc vào cấu trúc và thành phần của phân tử.
Liên kết hóa học
Khả năng hình thành liên kết hóa học là yếu tố quyết định đến tính chất và hoạt động của phân tử. Các loại liên kết hóa học chính bao gồm liên kết cộng hóa trị (chia sẻ electron), liên kết ion (tạo thành từ sự hấp dẫn giữa các ion) và liên kết van der Waals (tương tác yếu giữa các phân tử không phân cực).
Phân loại phân tử
Phân tử có thể được phân loại thành nhiều loại khác nhau dựa trên các tiêu chí như thành phần nguyên tử và cấu trúc. Sự phân loại này không chỉ giúp chúng ta dễ dàng trong việc nhận dạng và nghiên cứu mà còn giúp phát hiện được tính chất và ứng dụng của chúng.
Phân tử đơn chất
Phân tử đơn chất được hình thành từ các nguyên tử của cùng một nguyên tố hóa học. Điều này có nghĩa là mọi nguyên tử trong phân tử đều giống nhau về mặt cấu trúc và hóa học. Chúng thường tồn tại ở nhiều trạng thái vật lý khác nhau. Ví dụ:
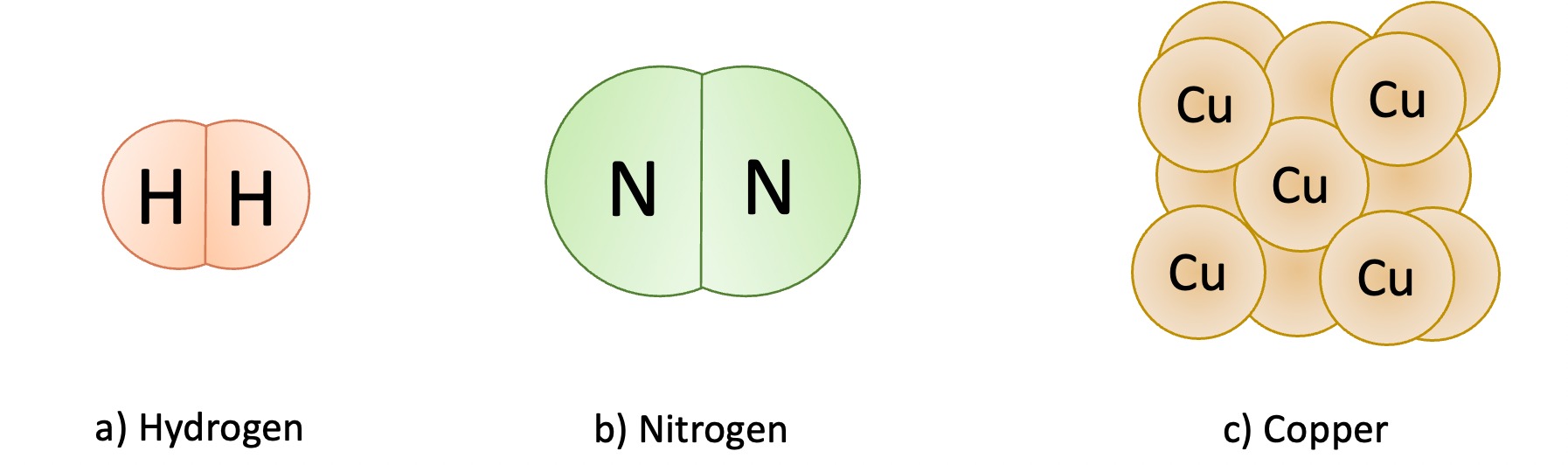
Phân tử đơn chất
-
Oxy (O₂): Là phân tử khí gồm hai nguyên tử oxy, thường tồn tại trong không khí và rất cần thiết cho sự sống.
-
Nitơ (N₂): Là thành phần chính của không khí, bao gồm hai nguyên tử nitơ, không thể phản ứng với nhiều chất khác.
-
Chlorine (Cl₂): Chlorine tồn tại dưới dạng khí và thường được sử dụng làm chất tẩy rửa trong ngành công nghiệp.
Phân tử hợp
Ngược lại với phân tử đơn chất, phân tử hợp được hình thành từ hai hoặc nhiều nguyên tố khác nhau kết hợp lại. Các nguyên tử này có thể ở dạng nguyên tử hoặc ion và liên kết với nhau qua các liên kết hóa học. Một số ví dụ điển hình:
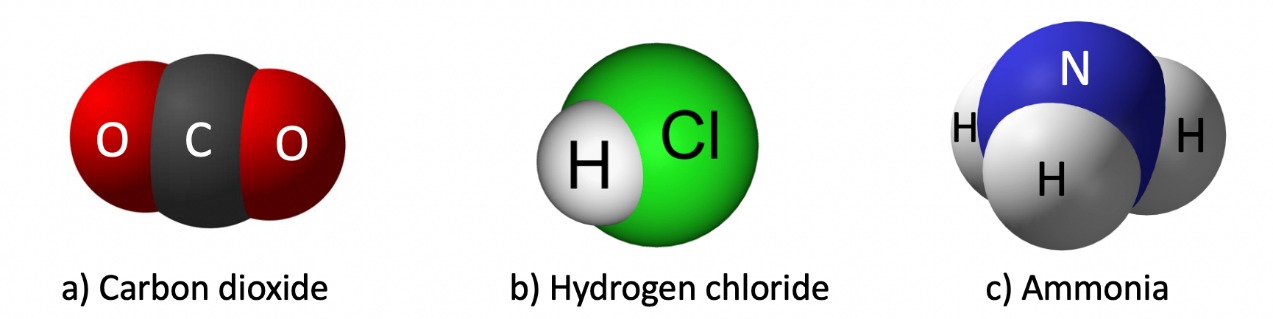
Phân tử hợp
-
Nước (H₂O): Đây là một phân tử hợp chất, được tạo thành từ hai nguyên tử hydro và một nguyên tử oxy, đóng vai trò cực kỳ quan trọng trong môi trường sống.
-
Glucose (C₆H₁₂O₆): Là phân tử carbohydrate chứa carbon, hydrogen, oxygen, đóng vai trò chính trong quá trình quang hợp của thực vật.
-
Acid nucleic (DNA, RNA): Những phân tử rất phức tạp, tham gia vào quá trình lưu trữ và truyền tải thông tin di truyền trong tế bào.
Vai trò của phân tử trong sinh học
Phân tử giữ một vị trí không thể thiếu trong sinh học, vì chúng là nền tảng cho mọi hoạt động sống diễn ra bên trong tế bào. Từ việc cấu tạo nên các mô, cơ quan cho tới việc tham gia vào các phản ứng sinh hóa, phân tử luôn hiện diện và hoạt động không ngừng trong vũ trụ sinh học.
-
Cấu trúc tế bào: Phân tử lipid sẽ tạo thành thành phần chính của màng tế bào, cung cấp sự bảo vệ và hỗ trợ cho các chức na-ng của tế bào. Bên cạnh đó, protein là yếu tố chính trong việc hình thành cấu trúc tế bào, giúp tế bào duy trì hình dạng và chức năng.
-
Chức năng của protein: Các protein không chỉ có vai trò trong việc cấu tạo tế bào mà còn tham gia vào việc điều chỉnh nhiều hoạt động sinh học khác nhau, như enzym, catecholamine trong hệ thống miễn dịch.
-
Thông tin di truyền: DNA và RNA là các phân tử hỗ trợ trong việc lưu trữ và truyền tải thông tin di truyền, giữ cho thế hệ sau có thể duy trì các đặc điểm quý giá.
-
Chuyển hóa năng lượng: Phân tử như glucose trong quá trình hô hấp tế bào sẽ được phân giải để giải phóng năng lượng cần thiết cho các phản ứng hóa học, duy trì sự sống.
Ứng dụng của phân tử trong công nghệ
Phân tử không chỉ đóng vai trò trong sinh học mà còn có ứng dụng rộng rãi trong công nghệ. Dưới đây là một số lĩnh vực công nghệ mà phân tử đã và đang được áp dụng một cách hiệu quả:
-
Công nghệ sinh học: Sử dụng các phân tử sinh học như DNA và protein trong các nghiên cứu liên quan đến di truyền, phát triển kỹ thuật chẩn đoán và điều trị bệnh.
-
Y học: Đặc biệt trong phát triển y học, nơi các phân tử cần được thử nghiệm và phân tích để đảm bảo tính an toàn và hiệu quả trong điều trị.
-
Công nghệ thực phẩm: Nghiên cứu thành phần hóa học trong thực phẩm nhằm đảm bảo chất lượng và an toàn thực phẩm cho người tiêu dùng.
-
Khoa học vật liệu: thiết kế và phát triển các loại polymer mới với các tính chất đặc biệt nhằm ứng dụng trong ngành chế tạo.
-
Công nghệ năng lượng: Nghiên cứu các phân tử có thể được xúc tác để tối ưu hóa quy trình phát điện, giảm thiểu năng lượng tiêu thụ.
-
Công nghệ dược phẩm: Việc phát triển công nghệ mới ngày càng phụ thuộc vào phân tích phân tử để xác định tính hoạt động và độ an toàn của thuốc.
Khối lượng phân tử là gì?
Khối lượng phân tử là tổng khối lượng của tất cả các nguyên tử có trong một phân tử. Nó cho biết khối lượng tương đối của một phân tử so với đơn vị khối lượng nguyên tử (amu hoặc u).
Cách tính khối lượng phân tử
Để tính khối lượng phân tử của một chất, ta thực hiện các bước sau:
-
Xác định công thức hóa học: Biết được công thức hóa học của chất đó.
-
Tìm khối lượng nguyên tử tương đối: Tra bảng tuần hoàn các nguyên tố để biết khối lượng nguyên tử tương đối của từng nguyên tố có trong phân tử.
-
Tính tổng: Nhân khối lượng nguyên tử tương đối của mỗi nguyên tố với số nguyên tử của nguyên tố đó trong phân tử, sau đó cộng tất cả các kết quả lại.
Ví dụ: Tính khối lượng phân tử của nước (H₂O).
-
Khối lượng nguyên tử tương đối của H là 1 amu.
-
Khối lượng nguyên tử tương đối của O là 16 amu.
-
Khối lượng phân tử của H₂O = 2 x 1 amu (H) + 16 amu (O) = 18 amu.
Đơn vị của khối lượng phân tử
-
amu (atomic mass unit): Đơn vị khối lượng nguyên tử, bằng 1/12 khối lượng của một nguyên tử carbon-12.
-
u (unified atomic mass unit): Đơn vị khối lượng thống nhất, tương đương với amu.
Ý nghĩa của khối lượng phân tử
-
So sánh khối lượng các phân tử: Giúp ta so sánh khối lượng của các phân tử khác nhau.
-
Tính toán trong hóa học: Được sử dụng trong các tính toán hóa học như tính thành phần phần trăm khối lượng các nguyên tố, tính số mol,...
Lưu ý:
-
Khối lượng phân tử là một đại lượng tương đối, không có đơn vị đo lường cụ thể như gam hay kilogam.
-
Khi nói về khối lượng phân tử, người ta thường nói đến khối lượng phân tử tương đối.
Ví dụ khác
Sự khác biệt giữa nguyên tử và phân tử
Nguyên tử và phân tử là hai khái niệm cơ bản trong hóa học, thường gây nhầm lẫn cho nhiều người. Dưới đây là những điểm khác biệt chính giữa hai khái niệm này:
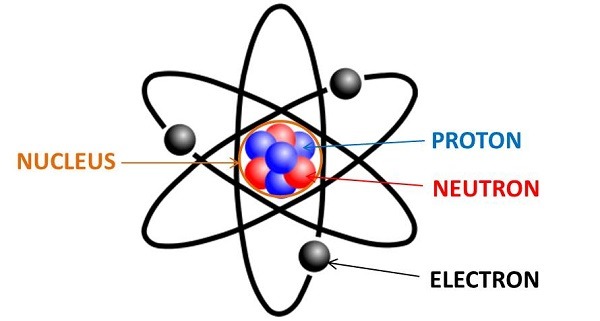
Sự khác biệt giữa nguyên tử và phân tử
Nguyên tử
-
Đơn vị nhỏ nhất: Nguyên tử là đơn vị nhỏ nhất của một nguyên tố hóa học vẫn giữ được tính chất hóa học của nguyên tố đó.
-
Cấu tạo: Nguyên tử bao gồm hạt nhân (chứa proton và neutron) và lớp vỏ (chứa electron).
-
Trung hòa điện: Nguyên tử trung hòa về điện vì số proton bằng số electron.
-
Không thể phân chia: Trong các phản ứng hóa học thông thường, nguyên tử không bị phân chia.
Phân tử
-
Nhóm các nguyên tử: Phân tử là một nhóm các nguyên tử liên kết với nhau bằng các liên kết hóa học.
-
Đại diện cho chất: Phân tử là hạt đại diện cho một chất, thể hiện đầy đủ tính chất hóa học của chất đó.
-
Trung hòa điện: Phân tử cũng trung hòa về điện.
-
Có thể phân chia: Phân tử có thể bị phân chia thành các nguyên tử trong các phản ứng hóa học.
Ví dụ:
-
Nguyên tử: Nguyên tử hidro (H), nguyên tử oxi (O).
-
Phân tử: Phân tử nước (H₂O), phân tử khí oxi (O₂).
Bảng so sánh:
|
Đặc điểm
|
Nguyên tử
|
Phân tử
|
|
Định nghĩa
|
Đơn vị nhỏ nhất của một nguyên tố
|
Nhóm các nguyên tử liên kết với nhau
|
|
Cấu tạo
|
Hạt nhân và lớp vỏ
|
Nhiều nguyên tử liên kết
|
|
Tính chất
|
Giữ nguyên tính chất của nguyên tố
|
Thể hiện tính chất của chất
|
|
Phân chia
|
Không thể phân chia trong phản ứng hóa học
|
Có thể phân chia thành các nguyên tử
|
Tổng kết lại, bài viết trên của Đông Á đã truyền tải một cách rõ ràng và súc tích tầm quan trọng của việc hiểu về phân tử là . Để làm cho khối kiến thức của các bạn thêm thú vị và đa dạng hơn, bạn có thể truy cập website dongachem.vn để cập nhật thêm nhiều bài viết về các chủ đề khác nữa các bạn nhé!