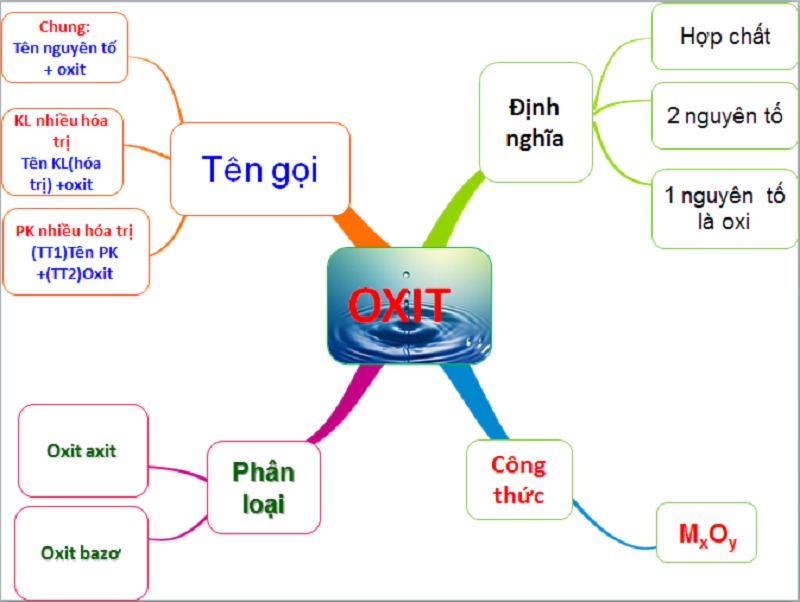
1. Oxit axit là gì?

Khái niệm oxit axit là gì?
Oxit axit thường là kết hợp oxit của các nguyên tố phi kim và tương ứng với một axit. Chúng có khả năng phản ứng với nước để tạo ra axit hoặc tương tác với kiềm để tạo thành muối hóa học (theo Wikipedia.org).
Các ví dụ phổ biến về oxit axit bao gồm Cacbon dioxit (CO2), lưu huỳnh đioxit (SO2), và lưu huỳnh trioxit (SO3)...
2. Cách đọc tên oxit axit đúng

Cách đọc tên oxit axit đúng
Để đọc tên oxit axit một cách đúng chuẩn và nhận biết dễ dàng oxit nào là oxit axit, bạn có thể sử dụng công thức quan trọng sau:
Tên oxit axit: (Tên tiền tố chỉ số nguyên tử của phi kim) + Tên phi kim + (Tên tiền tố số nguyên tử của oxi) + "Oxit."
Ví dụ:
N2O5: Đinitơ pentaoxit
SO3: Lưu huỳnh trioxit
UO2: Urani đioxit
Mn2O7: Đimangan heptaoxit
Theo cách này, bạn có thể dễ dàng đọc và hiểu tên của các oxit axit.
3. Tính chất hóa học quan trọng của oxit axit là gì?
Tính chất hóa học quan trọng của oxit axit
Cùng tìm hiểu về tính chất hóa học của oxit axit được thể hiện rõ như sau:
Hầu hết các oxit axit có khả năng tan trong nước, tạo ra dung dịch oxit axit. Ví dụ, khi oxit axit SO3 tác động với nước, chúng tạo ra axit sulfuric (H2SO4):
SO3 + H2O → H2SO4
Tương tự, CO2 tạo thành axit cacbonic (H2CO3) và P2O5 tạo thành axit photphoric (H3PO4) khi tác động với nước.
-
Tác dụng với oxit bazơ tạo ra muối:
Oxit axit có thể tác động cùng oxit bazơ để tạo ra muối.
Ví dụ như, cho SO3 và CaO phản ứng với nhau tạo ra muối canxi sulfat (CaSO4). P2O5 và Na2O tạo thành muối photphat natri (Na3PO4).
Bazơ tan bao gồm các bazơ của kim loại kiềm và kiềm thổ như NaOH, KOH, Ca(OH)2, và Ba(OH)2.
Chúng có thể tác động với oxit axit, tạo ra muối trung hòa hoặc muối axit, tùy thuộc vào tỷ lệ mol giữa oxit axit và bazơ tham gia phản ứng.
-
Gốc axit tương ứng có hóa trị II hoặc III:
Tùy theo tỷ lệ mol giữa bazơ và oxit axit, sản phẩm sau phản ứng có thể là muối axit hoặc muối trung hòa.
Ví dụ, khi tỷ lệ mol là 2, tạo ra muối axit (ví dụ: NaOH + SO2 → NaHSO3),
và khi tỷ lệ mol là 4, tạo ra muối trung hòa (ví dụ: P2O5 + 4NaOH → 2NaH2PO4).
Đối với kim loại có hóa trị II, tỷ lệ mol bazơ và oxit axit cũng quyết định sản phẩm là muối axit (ví dụ: CO2 + Ca(OH)2 → CaCO3) hoặc muối trung hòa (ví dụ: SiO2 + Ba(OH)2 → BaSiO3).
Cách tính chất này rất quan trọng để hiểu và dự đoán các phản ứng hóa học liên quan đến oxit axit.
4. Phân loại oxit axit

Phân loại oxit axit
Hiện nay, oxit được phân loại dựa trên tính chất hóa học của chúng thành bốn loại chính:
Đây là loại oxit có khả năng tác động với bazơ để tạo ra muối và nước. Chúng cũng có khả năng phản ứng với nước để tạo ra axit tương ứng.
Oxit này có tính chất đối nghịch với oxit axit. Chúng tác động với axit để tạo ra muối và nước. Một số oxit bazơ, khi phản ứng với nước, tạo thành các bazơ tan được gọi là kiềm.
Loại oxit này có khả năng tác động được cả với axit và bazơ, tạo ra muối và nước. Chúng làm cho việc phân loại trở nên khá phức tạp vì chúng có tính chất trung gian giữa oxit axit và oxit bazơ.
Đây là loại oxit không phản ứng với nước, cũng không tác động với bazơ hoặc axit. Tính chất trung tính của chúng làm cho chúng phù hợp trong nhiều ứng dụng và không tham gia tích cực trong các phản ứng hóa học.
Sự phân loại này dựa trên tính chất hóa học của oxit và giúp chúng ta hiểu rõ hơn về cách chúng tương tác với các chất khác trong các phản ứng hóa học.
5. Các dạng bài tập của oxit axit

Các dạng bài tập của oxit axit
Bài tập 1: Phản ứng của oxit axit với bazơ
Khi oxit axit như CO2 hoặc SO2 tác động với dung dịch bazơ như KOH hoặc NaOH, chúng ta có các phản ứng như sau:
Phương trình hóa học:
CO2 + NaOH → NaHCO3
CO2 + 2NaOH → Na2CO3 + H2O
Cách giải:
Bước 1: Đầu tiên, xem xét tỉ lệ mol giữa bazơ và oxit axit, ký hiệu là T.
Nếu T ≤ 1: Kết quả là muối axit, tức là chỉ có phản ứng (1) xảy ra.
Nếu 1 < T < 2: Kết quả là cả muối axit và muối trung hòa, nghĩa là cả hai phản ứng (1) và (2) đều xảy ra đồng thời.
Nếu T ≥ 2: Kết quả là chỉ có phản ứng (2) xảy ra.
Bước 2: Viết phương trình phản ứng và tính toán dựa trên phương trình tương ứng (nếu có cả hai phản ứng xảy ra, cần thiết lập các biểu thức và giải theo hệ phương trình).
Bước 3: Cần tính toán theo các yêu cầu của đề bài đã cho
Khi oxit axit như CO2 hoặc SO2 tác động với dung dịch kiềm thổ như Ca(OH)2 hoặc Ba(OH)2, chúng ta có các phản ứng như sau:
Phương trình phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
2CO2 + Ca(OH)2 → Ca(HCO3)2
Cách giải:
Bước 1: Bắt đầu bằng việc xét tỷ lệ mol giữa bazơ và oxit axit, ký hiệu là T.
Nếu T ≤ 1: Kết quả là muối trung hòa, tức là chỉ có phản ứng (1) xảy ra.
Nếu 1 < T < 2: Kết quả là cả muối axit và muối trung hòa, nghĩa là cả hai phản ứng (1) và (2) đều xảy ra đồng thời.
Nếu T ≥ 2: Kết quả là chỉ có phản ứng (2) xảy ra.
Bước 2 và Bước 3: Tiếp theo, viết phương trình phản ứng và thực hiện tính toán dựa trên phương trình tương ứng. Các bước này tương tự như trường hợp 1.

Dạng bài tập về oxit axit
Bài tập 2: Tiến hành sục khí CO2 ở điều kiện tiêu chuẩn vào một lượng dư dung dịch Ca(OH)2. Cần tính khối lượng kết tủa thu được sau phản ứng là bao nhiêu?
Lời giải:
Theo đề bài, ta tính được số mol CO2: nCO2 = 5,6/22,4 = 0,25 mol.
Do Ca(OH)2 dư, ta có phương trình phản ứng sau:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,25 0,25 0,25
Từ phương trình, ta thấy rằng số mol của CaCO3 (kết tủa) cũng là 0,25 mol.
Dùng khối lượng mol của CaCO3 và khối lượng mol của CO3 để tính khối lượng kết tủa:
m CaCO3 = 0,25 x (40 + 12 + 3 x 16) = 25 g
Kết luận:
Sau phản ứng, ta thu được kết tủa có khối lượng là 25 gram.
Bài tập 3: Tiến hành dẫn 2,24 lít khí SO2 ở điều kiện tiêu chuẩn vào 150 ml dung dịch NaOH 1 M. Tính nồng độ mol của các chất dung dịch đã có ở phản ứng.
Lời giải:
Theo đề bài, ta tính được số mol SO2: nSO2 = 2,24/22,4 = 0,1 mol và nNaOH = CM.V = 1 x 0,15 = 0,15 mol.
Phương trình phản ứng là:
SO2 + 2NaOH → Na2SO3 + H2O
0,1 0,15
0,075 0,15 0,075
Ta thấy SO2 dư, nên số mol muối Na2SO3 (0,075 mol) sẽ là sản phẩm cuối cùng.
Nếu tiếp tục phản ứng, theo phương trình:
SO2 + Na2SO3 + H2O → 2NaHSO3
0,075 0,075
0,075 0,075 0,15
Chúng ta thấy rằng NaHSO3 cũng dư. Vì vậy, chỉ có Na2SO3 tạo thành.
nNa2SO3 = 0,075 mol
Kết luận:
Trong dung dịch sau phản ứng, nồng độ mol của Na2SO3 là 0,075 M.
6. Tổng kết
Chúng tôi đã cung cấp thông tin cơ bản về oxit axit, bao gồm khái niệm oxit axit là gì? cách gọi tên, tính chất hóa học và cách giải bài tập liên quan. Hy vọng rằng bạn hiện đã hiểu hơn về loại hợp chất này. Nếu bạn có bất kỳ thắc mắc hoặc cần thêm thông tin, hãy liên hệ với Đông Á Chemical qua hộp thoại hỗ trợ trực tuyến 24/7. Chúng tôi sẵn sàng hỗ trợ bạn để giải quyết mọi thắc mắc và cung cấp thông tin thêm về oxit axit.