Cấu trúc phân tử của NO3
Cấu trúc phân tử của ion nitrat NO3- có thể được hình dung như một tác phẩm nghệ thuật hoàn hảo của thiên nhiên, nơi mà các nguyên tử liên kết với nhau theo cách tạo ra sự ổn định và chính xác cao nhất. Ion nitrat bao gồm một nguyên tử nitơ (N) ở trung tâm, cùng với ba nguyên tử oxy (O). Tương tự như một chiếc bàn cân, ion này có sự phân bố đều giữa các nguyên tử oxy, tạo nên một hình dáng giống như tam giác phẳng.
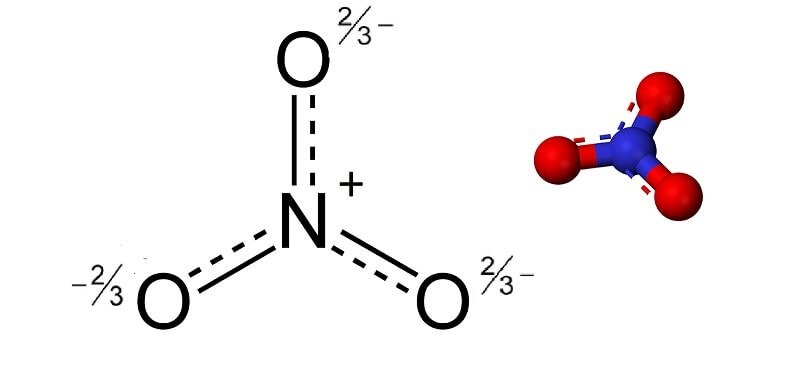
Cấu trúc phân tử của NO3
Đầu tiên, chúng ta hãy xem xét các liên kết trong ion. Các góc liên kết giữa nitơ và oxy khoảng 120°, cho thấy rằng các liên kết này không chỉ đồng nhất mà còn tạo ra sự cân bằng. Số lượng electron hóa trị trong ion NO3- là 24, tương ứng với:
Tổng cộng, 5 + 18 + 1 = 24 electron. Trong ion này, có một cặp electron được chia sẻ giữa nitơ và một trong các nguyên tử oxy, tạo ra liên kết đôi. Điều này dẫn đến việc ion nitrat có ba cấu trúc cộng hưởng, làm tăng cường sự ổn định cho ion này.
Giải đáp NO3 hóa trị mấy?
Như đã đề cập, ion nitrat NO3- có hóa trị là -1. Điều này cho thấy khả năng của ion này trong việc nhận hoặc nhường electron, một tính chất lý thú mà nhiều người chưa từng nghĩ đến. Khi phân tích sâu hơn, chúng ta nhận thấy rằng:
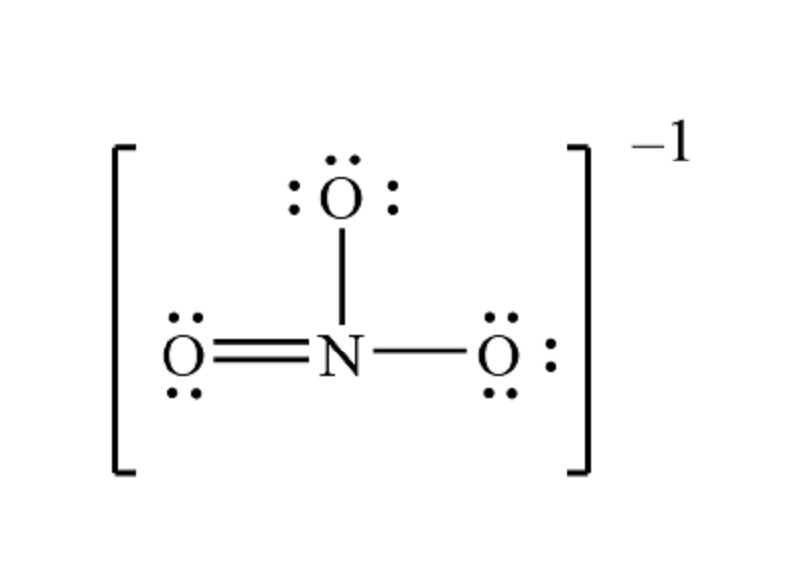
Gốc NO3 hóa trị -1
Cấu tạo của nhóm NO₃: Nhóm nitrat gồm một nguyên tử nitơ (N) liên kết với ba nguyên tử oxi (O). Nguyên tử nitơ có 5 electron lớp ngoài cùng, trong khi mỗi nguyên tử oxi có 6 electron lớp ngoài cùng. Để đạt được cấu hình electron bền vững, nguyên tử nitơ cần thêm 1 electron, còn mỗi nguyên tử oxi cần thêm 2 electron.
Phân bố điện tích: Trong nhóm nitrat, nguyên tử nitơ mang điện tích dương một phần, trong khi các nguyên tử oxi mang điện tích âm một phần. Do đó, để cân bằng điện tích, toàn bộ nhóm NO₃ mang điện tích âm 1.
Ví dụ:
-
Natri nitrat (NaNO₃): Trong hợp chất này, nguyên tử Na có hóa trị +1 kết hợp với nhóm NO₃ có hóa trị -1 để tạo thành hợp chất trung hòa về điện.
-
Kali nitrat (KNO₃): Tương tự, nguyên tử K có hóa trị +1 kết hợp với nhóm NO₃ có hóa trị -1.
Lưu ý:
-
Hóa trị của một nhóm nguyên tử là điện tích của nhóm nguyên tử đó khi nó kết hợp với các nguyên tử hoặc nhóm nguyên tử khác để tạo thành hợp chất.
-
Hóa trị của nhóm NO₃ luôn là -1 trong tất cả các hợp chất.
Nguồn gốc phát sinh NO3
Ion nitrat NO3- không chỉ xuất hiện một cách ngẫu nhiên mà có nguồn gốc rất cụ thể từ thiên nhiên. Nguồn gốc phát sinh của NO3- chủ yếu đến từ nitơ có trong không khí và trong lòng đất. Nitơ, chiếm tỷ lệ lớn nhất trong bầu khí quyển, qua các quá trình sinh học và hóa học sẽ trở thành nitrate – một điều thiết yếu cho vòng tuần hoàn nitơ.
Nguồn gốc phát sinh NO3
Trong quá trình phân hủy xác động thực vật, vi khuẩn và các sinh vật khác đóng vai trò trung gian trong việc chuyển hóa nitơ thành dạng mà cây có thể hấp thụ, ion NO3-. Điều này cũng giải thích tại sao phân bón có chứa nitrat rất được ưa chuộng trong nông nghiệp. Không chỉ cung cấp dinh dưỡng mà còn là kết quả của sự liên kết tuyệt vời giữa sinh vật và môi trường.
NO3 trong môi trường
Sự tồn tại của ion nitrat NO3- trong môi trường không chỉ là một hiện tượng tự nhiên, mà còn đóng vai trò thiết yếu trong sự sống của các sinh vật. Ion nitrat là một trong những nguồn dinh dưỡng quan trọng mà thực vật cần để có thể phát triển mạnh mẽ và bền vững. Tuy nhiên, khi nồng độ của nó trong môi trường trở nên quá cao, chúng có thể gây ra những tác động tiêu cực không chỉ cho hệ sinh thái mà còn cho sức khỏe con người.
Trong môi trường nước, ion NO3- tham gia vào nhiều phản ứng hóa học quan trọng. Đây không chỉ là chất dinh dưỡng cung cấp cho thực vật, mà cũng là sản phẩm của quá trình phân hủy hữu cơ và hoạt động của vi khuẩn. Một điều thú vị là trong điều kiện nhất định, ion nitrat có thể chuyển hóa thành nitơ và thoát ra ngoài không khí, điều này giúp giảm thiểu nồng độ nitrat trong nước.
Tuy nhiên, nếu nồng độ NO3- vượt quá giới hạn an toàn, nó có thể dẫn đến ô nhiễm nguồn nước, ảnh hưởng xấu đến sức khỏe con người chẳng hạn như tình trạng "bệnh xanh hóa" hay còn gọi là hiện tượng vỏ xanh trong nước. Những vấn đề này không chỉ gây thiệt hại cho hệ sinh thái mà còn làm tăng chi phí xử lý nước và ảnh hưởng đến hoạt động nông nghiệp.
Ứng dụng của NO3-trong nông nghiệp
Ion nitrat NO3- được biết đến là một hợp chất không thể thiếu trong nông nghiệp, đặc biệt trong việc cung cấp dinh dưỡng cho cây trồng. Sự hiện diện của NO3- không chỉ thúc đẩy sự phát triển của thực vật mà còn ảnh hưởng đến chất lượng và năng suất cây trồng. Dưới đây là một số ứng dụng cụ thể mà ion nitrat mang lại trong lĩnh vực nông nghiệp:
Phân bón cung cấp nitơ
Nitơ là một trong những nguyên tố đa lượng cần thiết cho sự phát triển của thực vật. Ion nitrat cung cấp nitơ dưới dạng dễ hấp thụ nhất cho cây trồng, giúp chúng phát triển mạnh mẽ, tăng cường quang hợp và khả năng sinh trưởng.
Cải thiện chất lượng sản phẩm
Phân bón có chứa ion NO3- giúp nâng cao chất lượng của nông sản, như tăng cường hương vị, màu sắc và giá trị dinh dưỡng của rau quả. Những sản phẩm này không chỉ tốt cho sức khỏe mà còn thu hút người tiêu dùng.
Tăng năng suất cây trồng
Khi cung cấp đủ lượng nitrat cho cây, nông dân có thể kỳ vọng vào một vụ mùa bội thu. Việc tối ưu hóa dinh dưỡng cho cây thông qua phân bón nitrat giúp tăng đều năng suất và duy trì sức khỏe tốt cho cây trồng.
Quản lý dinh dưỡng cây trồng
Thông qua việc điều chỉnh lượng nitrat trong đất, nông dân có thể cải thiện hiệu quả sử dụng phân bón, tiết kiệm chi phí và bảo vệ môi trường. Điều này không chỉ có lợi cho sản xuất mà còn thúc đẩy sự phát triển bền vững cho ngành nông nghiệp.
Phản ứng hóa học liên quan đến NO3-
Một thế giới đầy màu sắc và phức tạp khác mở ra khi chúng ta xem xét các phản ứng hóa học liên quan đến ion nitrat NO3- . Những phản ứng này không chỉ có ý nghĩa lý thuyết mà còn có ứng dụng thực tiễn trong nông nghiệp và các lĩnh vực khoa học khác. Dưới đây là một số phản ứng hóa học quan trọng mà ion NO3- tham gia:
Phản ứng hóa học liên quan đến NO3-
-
Số oxi hóa của NO3- : Trong ion nitrat, nitơ mang số oxi hóa là +5, cho thấy rằng nó đã mất đi năm electron để kết hợp với ba nguyên tử oxy. Điều này thể hiện tính chất oxy hóa của nó.
-
Phản ứng hóa học với H+: Trong môi trường axit, ion NO3- có thể phản ứng với ion H+ để tạo thành axit nitric (HNO3). Đây là một phản ứng quan trọng trong nhiều quy trình hóa học, đặc biệt trong một số phương pháp phân tích hóa học.
-
Phản ứng với OH-: Khi NO3- tương tác với ion hydroxide (OH-), có thể xảy ra phản ứng khử, tạo thành ion NO2- và nước. Phản ứng này diễn ra trong môi trường kiềm và rất quan trọng trong lĩnh vực xử lý nước thải.
Cách nhận biết ion nitrat (NO3)
Nhận biết ion nitrat NO3- là một yếu tố quan trọng trong việc xác định thành phần hóa học của nhiều dung dịch. Có một số phương pháp hiệu quả mà bạn có thể áp dụng để phát hiện sự hiện diện của ion này trong phòng thí nghiệm. Dưới đây là những thông tin chi tiết về cách nhận biết ion nitrat cùng với hóa trị của nó:
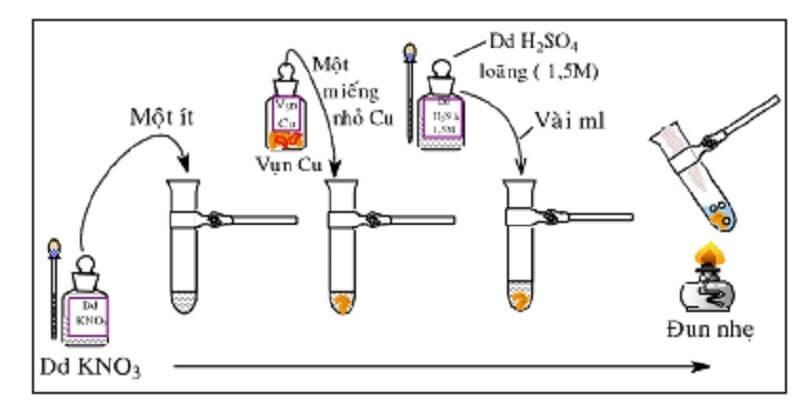
Phương pháp sử dụng đồng và axit sulfuric
Một phương pháp phổ biến là thêm một ít vụn đồng (Cu) vào dung dịch có chứa ion NO3- cùng với dung dịch axit sulfuric (H2SO4) loãng, sau đó đun nóng nhẹ. Hiện tượng quan sát được là:
-
Dung dịch sẽ chuyển sang màu xanh do sự hòa tan của đồng và giải phóng khí NO (không màu) thoát ra.
-
Khi khí NO tiếp xúc với oxy trong không khí, nó sẽ chuyển đổi thành khí NO2 (có màu nâu đỏ).
Sử dụng thuốc thử Diphenylamine
Phương pháp này khi thêm thuốc thử này vào dung dịch chứa ion nitrat sẽ tạo ra màu xanh đặc trưng.
Lưu ý về tính chất hóa học của ion nitrat:
-
Trong môi trường trung tính, ion NO3- không có tính oxi hóa.
-
Trong môi trường axit, ion NO3- thể hiện tính oxi hóa tương tự như axit nitric (HNO3).
Như vậy, ion nitrat (NO3- ) không chỉ có hóa trị -1 mà còn có thể được nhận biết thông qua phản ứng với đồng và axit sulfuric, tạo ra hiện tượng màu xanh và khí màu nâu đỏ. Việc nhận biết ion nitrat không chỉ có giá trị trong phòng thí nghiệm mà còn là một phần thiết yếu trong quản lý dinh dưỡng cây trồng và môi trường.
Như vậy, qua bài viết này của Đông Á, chúng ta đã có cái nhìn sâu sắc về NO3 hóa trị mấy, từ cấu trúc phân tử đến hóa trị, nguồn gốc phát sinh, sự hiện diện trong môi trường, các ứng dụng trong nông nghiệp cũng như các phản ứng hóa học liên quan. Chúng ta cần nhận thức và áp dụng những hiểu biết này để tối ưu hóa việc sử dụng NO3- trong nông nghiệp, bảo vệ môi trường và tạo ra một tương lai xanh cho thế hệ tiếp theo.