Nitơ (N), một nguyên tố không thể thiếu trong cuộc sống cũng như trong các ngành công nghiệp, nằm trong nhóm phi kim, nó chưa bao giờ ngừng thể hiện sức mạnh và sự đa dạng trong các phản ứng hóa học cũng như vai trò của mình trong thiên nhiên. Bài viết này sẽ mang đến cái nhìn sâu sắc không chỉ về hóa trị của nitơ mà còn khắc họa rõ nét những nguyên nhân, tính chất và ứng dụng của nó trong cuộc sống thực tiễn. Dưới đây, chúng ta sẽ cùng nhau khám phá N hóa trị mấy, những điều ít ai biết về nitơ và lý do tại sao nó lại đặc biệt đến vậy trong nhiều lĩnh vực khoa học và công nghiệp.
Nitơ - N hóa trị mấy?
Nitơ (N) thường có hóa trị III và V, tuỳ thuộc vào loại hợp chất mà nó tham gia. Hóa trị III phổ biến hơn trong các hợp chất như amoniac (NH₃) và nitrit (NO₂⁻). Ở hóa trị này, nitơ liên kết với ba nguyên tử hydro hoặc các nguyên tử khác, thể hiện khả năng chia sẻ electron để tạo thành các liên kết vững chắc. Ngược lại, hóa trị V thường xuất hiện trong các hợp chất như axit nitric (HNO₃) và nitrat (NO₃⁻), nơi nitơ tham gia vào quá trình oxy hóa, liên kết với năm nguyên tử.
Nitơ - N hóa trị mấy?
Bảng hóa trị của N:
|
Hợp chất
|
Hóa trị của nitơ
|
|
Amoniac (NH₃)
|
III
|
|
Nitrit (NO₂⁻)
|
III
|
|
Axit nitric (HNO₃)
|
V
|
|
Nitrat (NO₃⁻)
|
V
|
Nguyên nhân nitơ - N có nhiều hóa trị khác nhau
Nitơ có nhiều hóa trị khác nhau không chỉ nhờ vào cấu trúc electron của nó mà còn do nhiều yếu tố khác nhau. Một trong những lý do quan trọng nhất chính là cấu hình electron của nitơ, khi mà nó có 5 electron ở lớp ngoài cùng (cấu hình: 1s² 2s² 2p³). Với cấu trúc này, nitơ có khả năng nhận, cho hoặc chia sẻ electron để tạo ra các liên kết hóa học linh hoạt, dẫn đến việc hình thành nhiều hợp chất khác nhau.
Một vài nguyên nhân chính cho đặc điểm hóa trị của nitơ:
-
Cấu trúc electron: Khả năng cho và nhận electron rất mạnh mẽ, giúp nitơ xây dựng liên kết bền vững với nhiều nguyên tử khác.
-
Định hình phân tử: Hóa trị của nitơ còn phụ thuộc vào cấu trúc không gian và kiểu liên kết của các nguyên tử xung quanh.
-
Tính linh hoạt trong phản ứng hóa học: Nitơ tham gia vào nhiều phản ứng khác nhau từ phản ứng khử đến oxy hóa, tạo ra nhiều sản phẩm hóa học khác nhau.
Tính chất của N - Nito
Nitơ (N) không chỉ đa dạng về hóa trị mà còn có những tính chất hóa học và vật lý độc đáo. Do chiếm khoảng 78% thể tích không khí, nitơ thể hiện vai trò quan trọng trong sự sống và trong nhiều quy trình công nghiệp. Dưới đây là một vài tính chất nổi bật của nitơ:
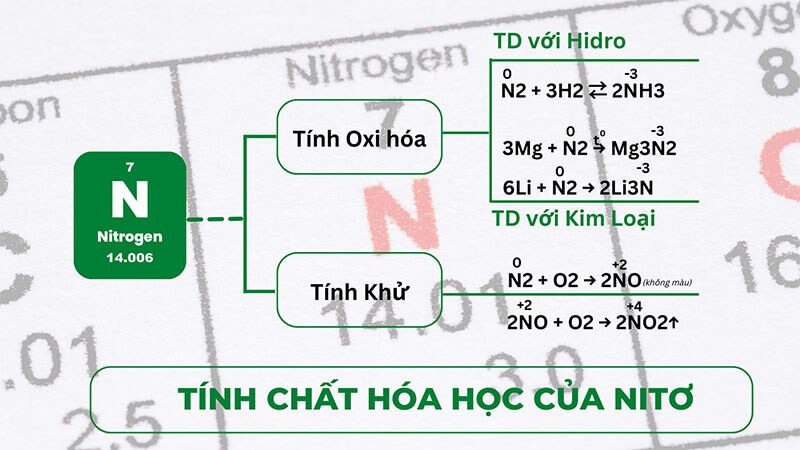
Tính chất của N - Nito
1. Tính chất vật lý:
-
Không màu, không mùi, không vị: Điều này làm cho nitơ trở thành một khí trơ trong tự nhiên, không gây hại đến sức khỏe con người.
-
Khí nhẹ hơn không khí: Tỉ khối khoảng 28/29, nitơ có khả năng dễ dàng khuếch tán trong không khí.
-
Nhiệt độ hóa lỏng: Nitơ trở thành lỏng tại nhiệt độ -196°C, cho phép nó được sử dụng trong nhiều ứng dụng công nghiệp và khoa học.
2. Tính chất hóa học:
-
Khí trơ trong điều kiện thường: Nitơ không tham gia vào nhiều phản ứng hóa học ở nhiệt độ phòng, nhưng có thể phản ứng với nguyên tố khác ở nhiệt độ cao.
-
Phản ứng với hydrogen: Khi có xúc tác và ở nhiệt độ cao, nitơ có thể tạo ra amoniac (NH₃) thông qua phản ứng:
N2 + 3H2 ⇄ 2NH3
-
Phản ứng với kim loại: Nitơ không phản ứng với hầu hết các kim loại ở nhiệt độ thường nhưng có thể tác động với litili hoặc một số kim loại khác ở nhiệt độ cao.
Tính chất của nitơ không chỉ làm cho nó trở thành một phần không thể thiếu của tự nhiên. Chúng còn chứng tỏ rằng các nguyên tố hóa học có thể ảnh hưởng tới đời sống một cách sâu sắc và rộng lớn.
Ứng dụng của nitơ trong đời sống
Nhờ vào sự đa dạng về hóa trị và các tính chất độc đáo của mình, nitơ đã được ứng dụng rộng rãi trong nhiều lĩnh vực. Có thể nói, nitơ đã khẳng định vị thế quan trọng của mình không chỉ trong ngành khoa học mà còn trong đời sống hàng ngày của chúng ta.

Ứng dụng của nitơ trong đời sống
1. Nông nghiệp:
-
Phân bón: Nitơ là thành phần chính trong hầu hết các loại phân bón, góp phần vào sự phát triển của cây trồng và tăng năng suất. Nó đóng vai trò quan trọng trong việc hình thành protein cũng như axit nucleic, giúp cây trồng phát triển tốt hơn.
-
Nâng cao chất lượng thực phẩm: Việc bổ sung nitơ vào đất giúp cải thiện chất lượng của sản phẩm nông nghiệp.
2. Công nghiệp:
-
Bảo quản thực phẩm: Khí nitơ được sử dụng để thay thế không khí trong bao bì thực phẩm, giúp ngăn ngừa sự phát triển của vi khuẩn và nấm mốc.
-
Môi trường trơ trong xử lý: Nitơ lỏng được sử dụng trong nhiều quá trình công nghiệp như hàn và bảo quản các mẫu sinh học, máu.
3. Chế biến thực phẩm:
Các ứng dụng của nitơ có vẻ đơn giản nhưng lại mang lại giá trị lớn cho xã hội. Từ việc chăm sóc cây trồng cho đến chế biến thực phẩm, nitơ không ngừng khẳng định vai trò vô giá của nó trong đời sống hàng ngày.
Phương pháp điều chế N - nitơ
Việc sản xuất nitơ có thể diễn ra trong cả phòng thí nghiệm và công nghiệp. Điều chế nitơ có thể được thực hiện qua nhiều phương pháp khác nhau, tùy thuộc vào yêu cầu và ứng dụng cụ thể. Dưới đây là một số phương pháp phổ biến:
1. Điều chế trong phòng thí nghiệm:

Điều chế trong phòng thí nghiệm
-
Phân hủy amoni nitrit: Đun nóng dung dịch amoni nitrit, nitơ được sinh ra:
NH₄NO₂ → N₂ + 2H₂O
-
Phân hủy nhiệt amoni dicromat: Khi đun nóng amoni dicromat, nitơ cũng được tạo ra:
(NH₄)₂Cr₂O₇ → Cr₂O₃ + N₂ + 4H₂O
2. Điều chế trong công nghiệp:
-
Chưng cất phân đoạn không khí lỏng: Đây là phương pháp phổ biến nhất, không khí được làm lạnh và sau đó nitơ được tách ra dựa trên sự khác biệt về điểm sôi.
-
Hấp thụ swing áp suất (PSA): Sử dụng vật liệu carbon để tách nitơ từ không khí, cho phép sản xuất nitơ có độ tinh khiết cao.
Việc sản xuất nitơ được thực hiện qua nhiều phương pháp khác nhau tuy nhiên, mỗi phương pháp đều có những ưu nhược điểm riêng. Vấn đề then chốt ở đây là cách mà nitơ được sản xuất phải đáp ứng được nhu cầu sử dụng trong các ngành công nghiệp và thực phẩm.
Nitơ không chỉ đơn thuần là một nguyên tố hóa học trong bảng tuần hoàn, mà nó còn mang trong mình nhiều tính chất độc đáo cùng vai trò tối quan trọng trong các lĩnh vực khác nhau. Đông Á mong rằng việc tìm hiểu và khám phá nitơ sẽ giúp chúng ta có cái nhìn sâu sắc hơn về N hóa trị mấy và cách ứng dụng hóa trị trong từng từng trường hợp cụ cụ thể.