Phản ứng nhiệt phân KClO₃ (kali clorat ) là một trong những phản ứng hóa học quan trọng trong lĩnh vực hóa học vô cơ. Đặc biệt, khi gặp nhiệt độ cao, KClO₃ sẽ phân hủy thành kali clorua (KCl) và oxy (O2), một sản phẩm có giá trị trong nhiều lĩnh vực. Không chỉ vậy, phản ứng này cũng có ý nghĩa quan trọng trong việc chế tạo chất oxy hóa mạnh, ứng dụng trong các ngành công nghiệp sản xuất thuốc nổ, pháo hoa, nhiều lĩnh vực khác. Trong bài viết này, chúng ta sẽ tìm hiểu chi tiết về các khía cạnh của phản ứng nhiệt phân KClO₃, từ phương trình phản ứng, điều kiện cần thiết, đến vai trò và ứng dụng thực tiễn.
Phản ứng nhiệt phân KClO₃
Kali clorat (KClO₃) là một chất rắn màu trắng, có tính oxi hóa mạnh. Khi đun nóng đến một nhiệt độ nhất định, KClO₃ sẽ phân hủy thành kali clorua (KCl) và khí oxi (O₂). Phản ứng này được gọi là phản ứng nhiệt phân. Sự chính xác trong điều kiện phản ứng sẽ quyết định chất lượng và lượng sản phẩm.
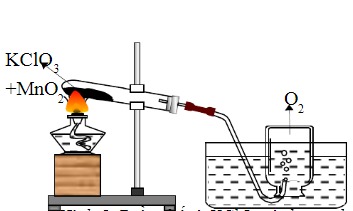
Phản ứng nhiệt phân KClO₃
Phương trình phản ứng
Khi diễn ra phản ứng nhiệt phân KClO₃, chúng ta gặp phải các phương trình phản ứng hóa học tiêu biểu như sau:
-
Ở nhiệt độ 400°C, sự phân hủy của KClO₃ tạo ra kali clorate (KClO4) và kali clorua (KCl): 4KClO₃ → 3KClO₄ + KCl
-
Ở nhiệt độ cao hơn, khoảng 500°C, phản ứng nhiệt phân kali clorat sẽ tạo ra kali clorua và khí oxy: 2KClO₃ (r) → 2KCl (r) + 3O₂ (k)
Nhìn vào những phương trình này, chúng ta có thể thấy rằng KClO₃ không chỉ phân hủy thành hai sản phẩm đơn giản mà còn tạo ra các hợp chất tiềm năng khác như KClO4. Điều này làm cho phản ứng trở nên đa dạng hơn, cũng như tạo ra nhiều ứng dụng khác nhau cho các sản phẩm thu được.
Điều kiện phản ứng
Phản ứng nhiệt phân kali clorat diễn ra trong một môi trường cần thiết để đảm bảo tính hiệu quả và an toàn. Dưới đây là những điều kiện cơ bản mà chúng ta cần lưu ý:
-
Nhiệt độ: KClO₃ cần được nung nóng, thường từ 400 °C đến 600 °C. Nhiệt độ này thiết lập môi trường thích hợp để phân hủy diễn ra nhanh chóng và hiệu quả.
-
Chất xúc tác: Sử dụng chất xúc tác như mangan dioxit (MnO2) giúp tăng tốc độ phản ứng. MnO2 không chỉ làm giảm nhiệt độ cần thiết mà còn tăng hiệu suất sản phẩm, cho phép quá trình phản ứng diễn ra một cách khỏi sắc nét và tối ưu hơn.
-
Áp suất: Áp suất ảnh hưởng đến sự hòa tan và phân hủy của KClO₃. Duy trì áp suất môi trường trong những giới hạn nhất định giúp kiểm soát quá trình phản ứng.
-
Thời gian phản ứng: Thời gian giữ nhiệt cũng cần được kiểm soát. Nếu không đủ thời gian, phản ứng có thể chưa diễn ra hoàn toàn; ngược lại, thời gian quá dài có thể dẫn đến sự phá hủy không mong muốn của sản phẩm.
Vai trò của chất xúc tác trong phản ứng
Mangan đioxit (MnO₂) đóng vai trò là chất xúc tác trong phản ứng nhiệt phân KClO₃. Chất xúc tác là chất làm tăng tốc độ phản ứng hóa học mà bản thân nó không bị biến đổi về khối lượng và thành phần hóa học sau phản ứng.
Cơ chế tác dụng của MnO₂:
-
MnO₂ cung cấp bề mặt tiếp xúc cho các phân tử KClO₃, giúp chúng phân hủy dễ dàng hơn.
-
MnO₂ tham gia vào một chuỗi phản ứng trung gian, làm giảm năng lượng hoạt hóa của phản ứng chính.
Cơ chế tác dụng
Khi KClO₃ gặp nhiệt độ cao, một loạt các phản ứng sẽ diễn ra trong suốt quá trình phân hủy:
-
Phân hủy hóa học: Khi KClO₃ bị đun nóng, các liên kết giữa các nguyên tử clor và oxy bắt đầu bị phá vỡ do năng lượng nhiệt cung cấp. Sự phá vỡ này giống như việc tách những trang sách ra để đọc từng phần riêng biệt. KClO₃ sẽ bị phân hủy thành KCl và O2 ở nhiệt độ 500°C hoặc cao hơn.
-
Sự giải phóng khí: Khí O2 được giải phóng trong quá trình phân hủy chính là điểm nhấn của phản ứng này. Tùy thuộc vào nhiệt độ, sản phẩm có thể thay đổi. Ở nhiệt độ cao hơn, phản ứng sẽ nhanh chóng đạt được trạng thái tách biệt, dẫn đến sự giải phóng oxy một cách mạnh mẽ.
-
Sự tham gia của chất xúc tác: Việc có mặt của mangan dioxit (MnO2) như một xúc tác không chỉ là phụ gia thụ động, mà nó làm tăng cường hiệu suất của phản ứng. Chất xúc tác giúp quá trình diễn ra một cách nhanh chóng và hiệu quả, đồng thời ổn định sản phẩm thu được.
|
Giai đoạn
|
Miêu tả
|
|
Phân hủy hóa học
|
Nhiệt độ cao phá vỡ liên kết
|
|
Giải phóng khí O2
|
Tách biệt và thoát ra khỏi phản ứng
|
|
Tham gia của MnO2
|
Tăng cường hiệu suất phản ứng
|
Ứng dụng của phản ứng nhiệt phân KClO₃
Phản ứng nhiệt phân KClO₃ không chỉ là một quá trình hóa học thú vị mà còn có rất nhiều ứng dụng trong thực tế, đóng góp vào nhiều lĩnh vực khác nhau trong cuộc sống hàng ngày của chúng ta. Chúng ta có thể chỉ ra một số ứng dụng nổi bật như sau:
Ứng dụng của phản ứng nhiệt phân KClO₃
-
Chế tạo oxy: Oxy tạo ra từ phản ứng nhiệt phân kali clorat thường được sử dụng trong các phòng thí nghiệm hóa học. Oxy là một trong những thành phần thiết yếu cho nhiều phản ứng hóa học khác và là nguyên liệu chủ yếu trong việc thực hiện những thí nghiệm sinh học.
-
Sản xuất vật liệu nổ: Trong ngành công nghiệp chế tạo thuốc nổ và pháo, kali clorat thường được sử dụng nhờ tính chất oxy hóa mạnh của nó, giúp tạo ra phản ứng cháy mạnh mẽ và sản xuất khí sau khi nổ.
-
Sản xuất diêm: KClO₃ chính là nguyên liệu quan trọng trong sản xuất diêm, chiếm tỉ lệ lớn trong thành phần của hỗn hợp đầu diêm (khoảng 50%). Điều này cho thấy sự cần thiết của KClO₃ trong quy trình sản xuất hàng hóa tiêu dùng.
-
Công nghiệp dệt nhuộm: KClO₃ cũng được ứng dụng trong ngành dệt để khử màu, giúp sản xuất ra các sản phẩm chất lượng cao hơn trong quy trình nhuộm vải. Việc sử dụng KClO₃ không chỉ nâng cao chất lượng sản phẩm mà còn đáp ứng các tiêu chuẩn an toàn trong ngành dệt.
-
Nông nghiệp: Trong nông nghiệp, KClO₃ được dùng để kích thích ra hoa và phát triển cho cây trồng, giúp tăng năng suất và chất lượng nông sản một cách hiệu quả.
Dưới đây là bảng tóm tắt một số ứng dụng nổi bật của phản ứng nhiệt phân KClO₃:
|
Lĩnh vực
|
Ứng dụng
|
|
Phòng thí nghiệm
|
Chế tạo khí oxy
|
|
Công nghiệp
|
Sản xuất thuốc nổ, pháo
|
|
Sản xuất diêm
|
Nguyên liệu chế tạo diêm
|
|
Ngành dệt nhuộm
|
Khử màu trong quá trình nhuộm
|
|
Nông nghiệp
|
Kích thích ra hoa, nâng cao năng suất
|
Lưu ý khi thực hiện phản ứng nhiệt phân KClO₃
Khi thực hiện phản ứng nhiệt phân KClO₃, có một số lưu ý quan trọng cần được quan tâm để đảm bảo an toàn và hiệu quả trong quy trình.
-
Kali clorat là chất oxi hóa mạnh: Khi tiếp xúc với các chất dễ cháy, KClO₃ có thể gây cháy nổ. Vì vậy, cần bảo quản KClO₃ ở nơi khô ráo, thoáng mát và tránh xa các nguồn nhiệt, tia lửa điện.
-
Thực hiện trong ống nghiệm chịu nhiệt: Để tránh ống nghiệm bị vỡ khi đun nóng.
-
Đặt ống nghiệm nghiêng miệng lên trên: Để khí oxi thoát ra dễ dàng và tránh bị hút ngược.
-
Đun nóng đều: Tránh đun nóng cục bộ để tránh gây nổ.
Dưới đây là bảng tóm tắt các lưu ý quan trọng khi thực hiện phản ứng nhiệt phân KClO₃:
|
Lưu ý
|
Chi tiết
|
|
Nhiệt độ phản ứng
|
Duy trì giữa 400 °C và 600 °C
|
|
Sử dụng chất xúc tác
|
Mangan dioxit (MnO₂)
|
|
An toàn xử lý
|
Tránh tiếp xúc với chất dễ cháy
|
|
Hiện tượng nhận biết
|
Giải phóng khí O₂
|
|
Phương trình phản ứng
|
2KClO₃ → 2KCl + 3O₂
|
Với những lưu ý này, quá trình phản ứng không chỉ an toàn mà còn hiệu quả hơn, đây chính là chìa khóa để thực hiện phản ứng nhiệt phân kali clorat thành công.
Hiện tượng nhận biết khi nhiệt phân Kali clorat
Khi nhiệt phân KClO₃ xảy ra, có nhiều hiện tượng nhận biết rõ ràng, giúp chúng ta dễ dàng theo dõi quá trình của phản ứng, tương tự như việc thấy những dấu hiệu của mùa thay đổi:
-
Giải phóng khí oxy: Một trong những hiện tượng dễ nhận biết nhất chính là sự giải phóng khí oxy (O2) trong quá trình phản ứng. Khí oxy phát ra thường có thể được nhận diện bằng sự sủi bọt trong nước hoặc sự cháy sáng của que diêm dính vào khí này.
-
Sự thay đổi màu sắc: Trong một số phản ứng, sản phẩm tạo ra có thể làm thay đổi màu sắc của môi trường xung quanh, cho thấy sự chuyển biến trong quá trình phản ứng.
-
Âm thanh phát ra: Trong một số trường hợp, phản ứng nhiệt phân có thể tạo ra âm thanh lớn hoặc tiếng nổ nhỏ khi khí oxy được giải phóng một cách nhanh chóng, tương tự như cảm giác của một buổi tiệc bất ngờ.
-
Hơi nóng tỏa ra: Quá trình nhiệt phân sẽ làm tăng nhiệt độ trong vùng phản ứng, khi cảm nhận hơi nóng, đó là dấu hiệu cho thấy phản ứng đang diễn ra.
-
Thay đổi trạng thái của chất: Một hiện tượng khác cũng quan trọng là sự chuyển hóa của trạng thái của KClO₃ khi nó biến đổi thành KCl và O2.
Dưới đây là bảng tóm tắt các hiện tượng nhận biết khi nhiệt phân kali clorat :
|
Hiện tượng
|
Miêu tả
|
|
Giải phóng khí oxy
|
Sủi bọt trong nước hoặc cháy sáng que diêm
|
|
Thay đổi màu sắc
|
Hiện tượng có thể làm môi trường xung quanh thay đổi màu
|
|
Âm thanh phát ra
|
Tiếng nổ nhỏ hoặc âm thanh khi khí giải phóng
|
|
Hơi nóng tỏa ra
|
Tăng nhiệt độ môi trường quanh phản ứng
|
|
Thay đổi trạng thái chất
|
Chuyển hóa từ KClO₃ thành KCl và O2
|
Những hiện tượng này không chỉ dễ dàng nhận biết mà còn cung cấp thông tin xác thực về sự diễn biến của phản ứng nhiệt phân KClO₃, mang lại sự hứng thú cho những ai quan tâm đến hóa học.
Tóm lại, phản ứng nhiệt phân KClO₃ là một phản ứng hóa học quan trọng, có nhiều ứng dụng trong cuộc sống. Tuy nhiên, khi tiến hành thí nghiệm, cần tuân thủ nghiêm ngặt các quy tắc an toàn để tránh xảy ra tai nạn. Hãy khám phá thêm nhiều bài viết khác tại dongachem.vn để thấy được sự đa dạng phong phú của các phản ứng hóa học các bạn nhé!