Natri oxit (Na₂O) là một hợp chất hóa học quan trọng trong hóa học vô cơ, thường được nhắc đến với vai trò của một oxit bazơ mạnh. Na₂O được hình thành từ natri và oxy, với công thức hóa học bao gồm hai nguyên tử natri và một nguyên tử oxy. Hợp chất này thường xuất hiện dưới dạng tinh thể màu trắng hoặc bột rắn, có thể tan trong nước tạo ra dung dịch kiềm mạnh (natri hydroxide - NaOH). Hãy cùng Đông Á Chemical khám phá kỹ hơn về Na₂O qua các phản ứng hóa học, tính chất vật lý, hóa học, các ứng dụng của nó trong công nghiệp.
Công thức hóa học và cấu trúc của Na₂O
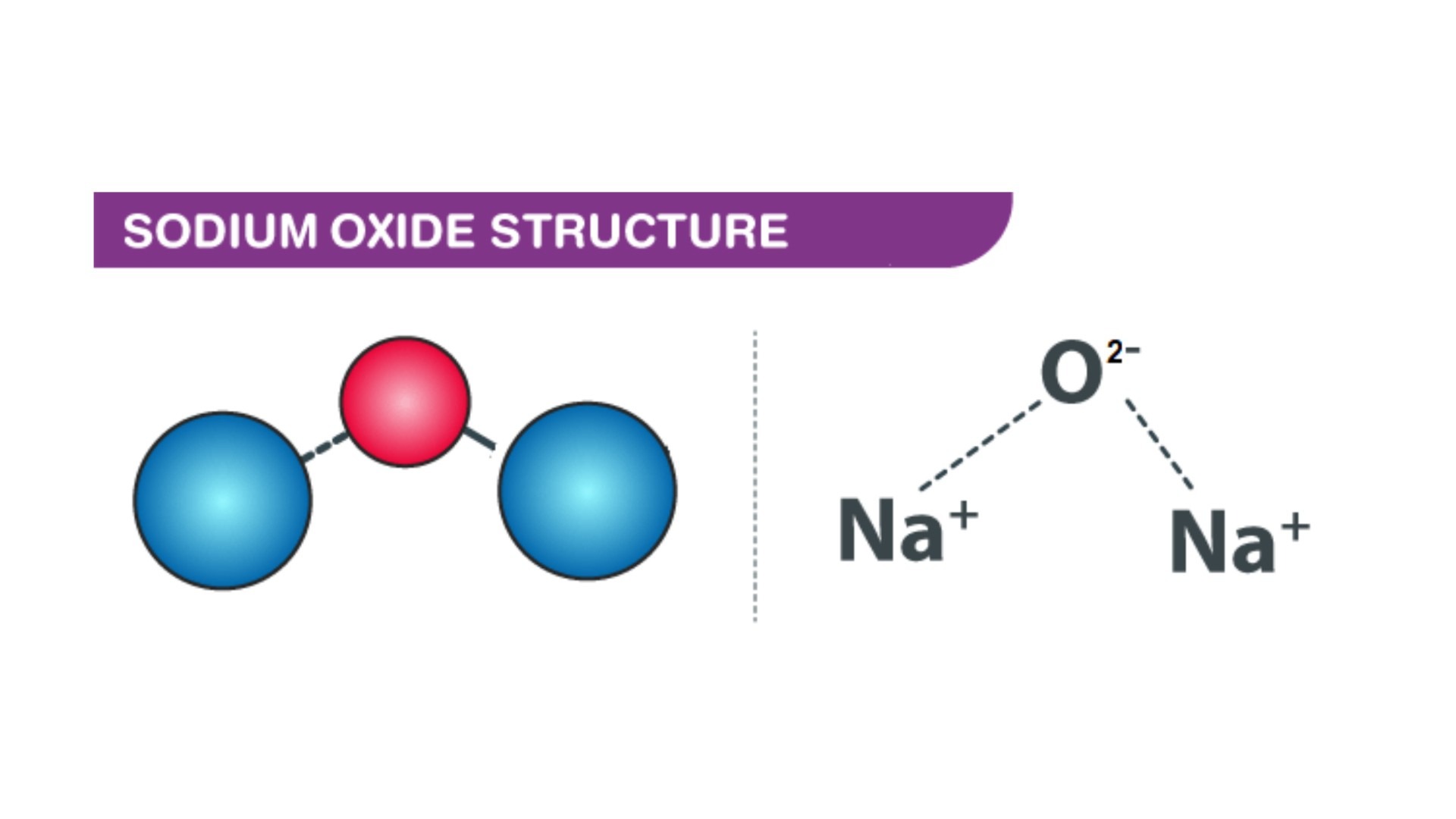
Công thức hóa học và cấu trúc
-
Mạng tinh thể: Trong mạng tinh thể của Na₂O, các ion Na⁺ và O²⁻ sắp xếp một cách đều đặn, tạo thành một cấu trúc lập phương tâm khối. Mỗi ion Na⁺ được bao quanh bởi 4 ion O²⁻ và ngược lại.
-
Công thức hóa học: Na₂O
-
Cấu trúc tinh thể: Hợp chất này có cấu trúc tinh thể rất tương đồng với cấu trúc antiflorit, trong đó các cation Na⁺ và anion O²⁻ chiếm giữ các vị trí tự do trong mạng tinh thể. Điều này cho phép hoạt động điện cực trong hợp chất, dẫn đến tính dẫn điện nhất định khi hòa tan trong nước.
Tính chất vật lý của Na₂O
Tính chất vật lý của natri oxit không chỉ định nghĩa cấu trúc và công thức hóa học của nó mà còn tạo nên sự phân biệt rõ rệt với các hợp chất khác. Natri oxit, dưới dạng bột màu trắng hoặc tinh thể, có những đặc điểm rất nổi bật như sau:

Tính chất vật lý của Na₂O
-
Hình thức: Natri oxit tồn tại dưới dạng bột rắn màu trắng, điều này không chỉ giúp nhận diện mà còn xác định cách bảo quản và sử dụng trong các ứng dụng công nghiệp.
-
Khối lượng phân tử: Khối lượng phân tử của natri oxit là 61.98 g/mol. Điều này đóng vai trò quan trọng trong việc tính toán phản ứng hóa học cũng như định lượng trong quy trình sản xuất.
-
Mật độ: Mật độ của natri oxit khoảng 2.27 g/ml, cho thấy rằng nó có một mật độ khá cao so với nhiều hợp chất hóa học khác.
-
Nhiệt độ nóng chảy: Nhiệt độ nóng chảy của natri oxit xấp xỉ 1275 °C. Nhiệt độ này là một yếu tố quan trọng khi xem xét khả năng chịu nhiệt và tính ổn định của hợp chất trong các điều kiện nhiệt độ cao.
-
Nhiệt độ sôi: Nhiệt độ sôi của natri oxit vào khoảng 1950 °C, tuy nhiên, nhiệt độ này, nó bắt đầu phân hủy thành natri và peroxide kim loại natri, điều này cần được lưu ý trong quá trình sản xuất.
-
Phản ứng với nước và tỏa nhiệt: Như đã đề cập, Na₂O phản ứng mạnh mẽ với nước, tạo ra natri hydroxide (NaOH) ngay lập tức và giải phóng một lượng nhiệt lớn. Điều này không những có giá trị trong lý thuyết mà còn trong việc sản xuất thực tế.
Tính chất hóa học của Na₂O
Tính chất hóa học của natri oxit không chỉ quan trọng trong việc nhận diện hợp chất mà còn là chìa khóa quyết định khả năng ứng dụng của nó trong nhiều lĩnh vực khác nhau. Dưới đây là một số điểm nổi bật về tính chất hóa học mà chúng ta cần lưu ý:
1. Tác dụng với nước:
2. Tác dụng với axit:
3. Tác dụng với oxit axit:
4. Tính bền nhiệt:
5. Tính khử:
Tổng kết:
-
Tính bazơ mạnh: Là tính chất đặc trưng nhất của natri oxit.
-
Tính phản ứng cao: Dễ dàng tham gia vào các phản ứng hóa học.
-
Không bền nhiệt: Phân hủy ở nhiệt độ cao.
Ứng dụng của Na₂O trong công nghiệp
Natri oxit không chỉ là một hợp chất hóa học mà còn là một thành phần thiết yếu trong nhiều ngành công nghiệp. Từ sản xuất thủy tinh đến chế biến gốm sứ, Na₂O đóng một vai trò quan trọng không thể thiếu. Dưới đây là các ứng dụng chủ yếu của natri oxit mà chúng ta cần lưu ý:
1. Sản xuất thủy tinh

Sản xuất thủy tinh
Na₂O là một thành phần quan trọng trong ngành công nghiệp sản xuất thủy tinh, nó chiếm khoảng 15% thành phần hóa học của thủy tinh. Natri oxit không chỉ giúp gia tăng độ bền của thủy tinh mà còn làm giảm nhiệt độ nóng chảy của silica. Điều này giúp tiết kiệm năng lượng khi sản xuất thủy tinh, đồng thời cải thiện tính chất cơ học và quang học của sản phẩm.
2. Chế biến gốm sứ
Trong ngành gốm sứ, hợp chất này cũng đóng một vai trò quan trọng trong việc tăng độ bền và độ sáng bóng của sản phẩm. Natri oxit giúp tạo ra một mạng lưới ổn định trong cấu trúc của gốm, giúp sản phẩm chịu áp lực cao và tránh được các vết nứt trong quá trình sử dụng.
3. Công nghiệp hóa chất
Nhiều loại hợp chất hóa học như natri silicat có nguồn gốc từ Na₂O. Natri silicat thường được sử dụng trong các sản phẩm tẩy rửa và làm chất kết dính trong xử lý nước. Natri oxit còn được sử dụng trong việc sản xuất các chất hóa học khác như sodium perborate, một hợp chất được sử dụng làm chất tẩy trắng trong bột giặt.
4. Làm chất chống ăn mòn

Làm chất chống ăn mòn
Natri oxit cũng có thể được sử dụng làm chất chống ăn mòn cho một số hợp kim kim loại. Việc thêm hợp chất này vào trong quá trình sản xuất giúp cải thiện độ bền và độ ổn định của các sản phẩm kim loại khi tiếp xúc với nước và hóa chất.
Điều chế natri oxit như thế nào?
Natri oxit là một hợp chất ion có tính bazơ mạnh và được ứng dụng rộng rãi trong nhiều lĩnh vực công nghiệp. Tuy nhiên, việc điều chế hợp chất này trực tiếp lại khá phức tạp và thường kèm theo một số khó khăn.
Phương pháp điều chế phổ biến
Phương pháp đơn giản nhất để điều chế natri oxit là đốt cháy natri kim loại trong điều kiện có đủ oxi. Tuy nhiên, phản ứng này thường không hoàn toàn và tạo ra hỗn hợp các oxit của natri, chủ yếu là natri peroxit (Na₂O₂) bên cạnh Na₂O.
Phản ứng: 4Na + O₂ → 2Na₂O
Các phương pháp khác
Lưu ý:
-
Phản ứng mạnh: Các phản ứng trên diễn ra rất mạnh và tỏa nhiệt, cần thực hiện trong điều kiện nhiệt độ và áp suất thích hợp, đồng thời tuân thủ nghiêm ngặt các quy tắc an toàn.
-
Khó tinh chế: Sản phẩm thu được thường là hỗn hợp các oxit của natri, việc tách riêng Na₂O ra khỏi hỗn hợp này khá khó khăn.
Khó khăn trong điều chế Na₂O tinh khiết
-
Tính phản ứng cao: Na₂O rất dễ phản ứng với nước và các chất khác trong không khí, do đó việc bảo quản và sử dụng Na₂O tinh khiết gặp nhiều khó khăn.
-
Khó tách khỏi các oxit khác: Như đã đề cập, việc tách Na₂O ra khỏi hỗn hợp các oxit của natri là một thách thức lớn.
Lưu ý khi sử dụng Na₂O
Khi làm việc với natri oxit chúng ta cần lưu ý nhiều yếu tố để đảm bảo an toàn và hiệu quả. Việc sử dụng và lưu trữ Na₂O một cách an toàn sẽ giúp giảm thiểu các rủi ro liên quan đến sức khỏe cũng như môi trường. Dưới đây là một số lưu ý quan trọng khi sử dụng natri oxit:
-
Tính nguy hiểm và độc hại
-
Hợp chất này có khả năng gây kích ứng cho mắt, da và hệ hô hấp. Khi tiếp xúc, nó có thể tạo ra các phản ứng dị ứng hoặc tổn thương, do đó, việc sử dụng thiết bị bảo hộ cá nhân như găng tay, kính bảo hộ và khẩu trang là điều cần thiết.
-
Phản ứng với nước
-
Như đã đề cập, natri oxit phản ứng rất mạnh với nước, tạo thành natri hydroxide (NaOH) và sinh nhiệt. Do đó, tránh tiếp xúc với nước và bảo quản ở nơi khô ráo rất quan trọng để ngăn chặn phản ứng không mong muốn.
-
Bảo quản và vận chuyển
-
Natri oxit nên được bảo quản trong các thùng kín và khô ráo, tránh xa nguồn ẩm và các chất oxy hóa. Khi vận chuyển, cần thực hiện cẩn thận, đặc biệt là trong các khu vực đông dân cư hoặc gần nguồn nước.
-
Quản lý và xử lý sự cố
-
Trong trường hợp có sự cố như tràn hoặc tiếp xúc không mong muốn, cần nhanh chóng rửa sạch vùng tiếp xúc với nước trong thời gian ít nhất 15 phút. Nếu cần, tham khảo ý kiến bác sĩ chuyên khoa để đảm bảo an toàn cho sức khỏe.
So sánh Na₂O với các oxit khác
Natri oxit là một oxit bazơ điển hình, có nhiều tính chất đặc trưng so với các loại oxit khác. Để so sánh một cách rõ ràng, chúng ta sẽ chia các oxit thành các nhóm chính và so sánh Na₂O với từng nhóm.
1. So sánh với các oxit bazơ khác (CaO, MgO, K₂O,...)
-
Tính bazơ: Tất cả các oxit bazơ đều có tính bazơ, nhưng độ mạnh yếu khác nhau. Na₂O là một trong những oxit bazơ mạnh nhất.
-
Tương tác với nước: Các oxit bazơ kiềm và kiềm thổ (như Na₂O, CaO, K₂O,...) đều tác dụng mạnh với nước tạo ra dung dịch bazơ tương ứng. Tuy nhiên, tốc độ phản ứng và độ tan của các bazơ thu được có thể khác nhau.
-
Ứng dụng: Các oxit bazơ thường được sử dụng để sản xuất bazơ, muối, thủy tinh, vôi sống,... Mỗi oxit có những ứng dụng cụ thể tùy thuộc vào tính chất của nó.
2. So sánh với các oxit axit (SO₂, CO₂, P₂O₅,...)
-
Tính chất: Oxit axit có tính axit, tác dụng với nước tạo thành dung dịch axit. Ngược lại, Na₂O có tính bazơ.
-
Phản ứng với nhau: Oxit bazơ và oxit axit tác dụng với nhau tạo thành muối. Ví dụ: Na₂O + SO₂ → Na₂SO₃
-
Ứng dụng: Oxit axit thường được sử dụng để sản xuất axit, muối, và các hợp chất khác.
3. So sánh với các oxit trung tính (CO, NO,...)
-
Tính chất: Oxit trung tính không có tính axit cũng không có tính bazơ, không tác dụng với nước, dung dịch axit hoặc dung dịch bazơ.
-
Ứng dụng: Oxit trung tính thường có các ứng dụng đặc biệt, ví dụ như CO được sử dụng làm chất khử.
Bảng so sánh tóm tắt
|
Tính chất
|
Na₂O (Oxit bazơ mạnh)
|
Oxit axit
|
Oxit trung tính
|
|
Tính chất hóa học
|
Tác dụng với nước tạo bazơ mạnh, tác dụng với axit tạo muối
|
Tác dụng với nước tạo axit, tác dụng với bazơ tạo muối
|
Thường trơ về mặt hóa học
|
|
Ứng dụng
|
Sản xuất bazơ, thủy tinh, gốm sứ
|
Sản xuất axit, muối, phân bón
|
Nhiên liệu, chất khử,...
|
Natri oxit trong môi trường và tác động của nó
Natri oxit không chỉ là một hợp chất hóa học quan trọng mà còn có những tác động không nhỏ đến môi trường. Sự tương tác của Na₂O với các yếu tố môi trường có thể dẫn đến nhiều hệ quả khác nhau, từ tác động tích cực đến tiêu cực. Dưới đây là những khía cạnh cần nhấn mạnh về tác động của Na₂O đối với môi trường:
1. Tác động đến nước
Khi natri oxit hòa tan trong nước, nó tạo thành dung dịch natri hydroxide (NaOH) kiềm mạnh, có thể gây hại cho sinh vật thủy sinh nếu không qua xử lý trước khi thải ra môi trường. Dung dịch này có thể làm giảm độ pH của nước, ảnh hưởng đến các loài sinh vật sống trong môi trường nước và làm suy giảm chất lượng nước.
2. Nguy cơ ô nhiễm đất
Việc sử dụng natri oxit một cách lạm dụng trong nông nghiệp có thể dẫn đến ô nhiễm đất. Hàm lượng kiềm trong đất tăng lên có thể làm giảm năng suất cây trồng, đồng thời có thể tạo khoảng cách sinh học cho nhiều vi sinh vật có ích trong đất.
3. Xử lý chất thải
Các chất thải từ quy trình sản xuất chứa Na₂O cần phải được xử lý cẩn thận. Nếu không sẽ gây ô nhiễm đất và nước ngầm, ảnh hưởng đến chất lượng nước sinh hoạt cũng như sức khỏe con người.
4. Quản lý và bảo vệ môi trường
Để giảm thiểu tác động của natri oxit đến môi trường, các biện pháp quản lý hiệu quả cần được thiết lập. Điều này bao gồm việc xử lý các chất thải một cách an toàn, hạn chế việc xả thải trực tiếp vào nước và đất, cũng như tăng cường giám sát chất lượng môi trường.
Các vấn đề an toàn liên quan đến Na₂O
Khi làm việc với natri oxit , sự an toàn là một yếu tố không thể thiếu. Mặc dù Na₂O có nhiều ứng dụng quan trọng trong ngành công nghiệp, nhưng đồng thời, nó cũng tiềm ẩn một số nguy hiểm nhất định. Dưới đây là những vấn đề an toàn chính mà bạn nên lưu ý khi tiếp xúc với natri oxit:
-
Tính độc hại
-
Na₂O có khả năng gây kích ứng cho mắt, da và hệ hô hấp. Việc tiếp xúc trực tiếp với Na₂O có thể gây ra các phản ứng dị ứng hoặc tổn thương nghiêm trọng, do đó bạn nên sử dụng thiết bị bảo hộ như găng tay, kính bảo hộ và khẩu trang.
-
Phản ứng với nước
-
Lưu trữ và vận chuyển
-
Hợp chất Na₂O cần được lưu trữ trong các thùng kín và khô ráo, tránh xa nguồn ẩm và các chất oxy hóa. Việc vận chuyển cũng cần thực hiện cẩn thận để tránh rơi vãi hoặc tràn, đặc biệt ở các khu vực đông dân cư.
-
Xử lý sự cố
-
Đạo đức và quy định
Natri oxit là một hợp chất hóa học không chỉ độc đáo trong cấu trúc mà còn quan trọng trong ứng dụng công nghiệp. Với tính chất hóa học mạnh mẽ, đặc biệt trong việc tạo ra natri hydroxide khi gặp nước, Na₂O đã góp phần không nhỏ vào các ngành công nghiệp như thủy tinh, gốm sứ và hóa chất. Tuy nhiên, đi kèm với những lợi ích này là những vấn đề an toàn và tác động đến môi trường mà chúng ta cần phải xem xét kỹ lưỡng. Để đảm bảo sử dụng hợp chất này hiệu quả và an toàn, việc áp dụng những biện pháp phòng ngừa và quản lý chất thải là rất cần thiết. Qua bài viết này, hóa chất Đông Á hy vọng bạn đã có cái nhìn toàn diện về Na₂O, từ cấu tạo, tính chất đến ứng dụng trong cuộc sống và các lĩnh vực khác nhau.