Lưu huỳnh, ký hiệu hóa học là S, với số nguyên tử là 16, là một nguyên tố phi kim quan trọng trong bảng tuần hoàn. Nguyên tố này thường được biết đến với hình thức rắn, có màu vàng nhạt và không có mùi. Vai trò của lưu huỳnh trong tự nhiên cũng như trong các phản ứng hóa học rất phong phú, góp phần đáng kể vào đời sống hàng ngày cũng như trong ngành công nghiệp. Nhưng thực tế, lưu huỳnh S hóa trị mấy luôn là câu hỏi nhận được sự quan tâm của nhiều người, để giải đáp hãy cùng Đông Á Chemical tìm hiểu trong bài viết dưới đây các bạn nhé!
Giải đáp lưu huỳnh S hóa trị mấy?
Lưu huỳnh có thể thể hiện nhiều hóa trị khác nhau, nhưng các hóa trị chủ yếu thường được biết đến là II, IV và VI. Hóa trị của S nối liền với tính chất của các hợp chất mà nó tạo ra. Một cách so sánh, việc xác định hóa trị của lưu huỳnh giống như việc một nghệ sĩ xác định màu sắc cho bức tranh của họ; tùy vào sắc thái mà nghệ sĩ muốn thể hiện, lựa chọn màu sắc sẽ khác nhau. Ví dụ, khi lưu huỳnh tham gia vào phản ứng với kim loại hoặc với hydro, nó có thể tạo ra sulfua, trong đó số oxi hóa của nó chuyển từ 0 xuống -2. Đây là minh chứng cho việc S có thể là một diễn viên chính trong các phản ứng hóa học.
Giải đáp lưu huỳnh S hóa trị mấy?
Ngoài ra, ở trạng thái hóa trị +4, S tạo ra các hợp chất như lưu huỳnh đioxit (SO₂), thường xuất hiện trong các quy trình công nghiệp, ví dụ như trong sản xuất điện và chất thải công nghiệp. Cuối cùng, ở hóa trị cao nhất là +6, lưu huỳnh biểu hiện tính oxi hóa mạnh khi tạo ra lưu huỳnh trioxit (SO₃), một thành phần quan trọng trong axit sunfuric. Từ những điểm này, có thể thấy rằng S không chỉ đơn thuần là một nguyên tố, mà còn là một phần không thể thiếu trong các phản ứng hóa học đa dạng mà chúng ta thấy trong đời sống hàng ngày.
Các hóa trị chính của lưu huỳnh S
Lưu huỳnh được biết đến với khả năng thể hiện nhiều hóa trị, trong đó ba hóa trị chính là II, IV và VI, mỗi hóa trị này lại phản ánh các ứng dụng cũng như tính chất riêng biệt của S trong các phản ứng hóa học và trong tự nhiên.
-
Hóa trị II: Lưu huỳnh có thể có hóa trị -2 trong một số hợp chất như hydrogen sulfide (H₂S). Trong trạng thái này, S tương tác với hydro và hình thành các liên kết mạnh mẽ, cho thấy khả năng của nó trong việc tạo ra các hợp chất có tính ổn định.
-
Hóa trị IV: Trong các hợp chất như sulfur dioxide (SO₂), lưu huỳnh thể hiện hóa trị +4. Hóa trị này cho thấy sự tham gia của S vào các quá trình oxi hóa, đóng vai trò quan trọng trong các chu trình sinh thái cũng như trong quá trình sản xuất công nghiệp.
-
Hóa trị VI: Ở hóa trị +6, lưu huỳnh tồn tại trong các hợp chất như sulfur trioxide (SO₃), thuộc loại hóa học có tính axit mạnh. Hóa trị này của S cho thấy khả năng oxi hóa mạnh, làm cho nó trở thành ứng cử viên lý tưởng cho việc sản xuất axit sunfuric trong công nghiệp.
So sánh hóa trị của S với các nguyên tố khác

S là một trong những nguyên tố có hóa trị đa dạng
So với các nguyên tố khác trong cùng nhóm 16 như oxy và selenium, lưu huỳnh có một số điểm tương đồng và khác biệt rõ ràng trong việc thể hiện hóa trị.
-
Hóa trị của oxy: Oxy thường xuất hiện với hóa trị -2 trong các hợp chất như nước (H₂O). Khác với lưu huỳnh, oxy không có hóa trị dương trong điều kiện bình thường. Điều này cho thấy rằng lưu huỳnh có khả năng linh hoạt hơn trong việc tham gia vào phản ứng hóa học.
-
Selenium và Tellurium: Hai nguyên tố này cũng có hóa trị đa dạng, trong đó selenium có thể có hóa trị -2, 0, +4, +6. Tuy nhiên, hóa trị của selenium và tellurium có thể ít ổn định hơn và phụ thuộc nhiều vào điều kiện môi trường.
|
Nguyên tố
|
Hóa trị chính
|
Đặc điểm nổi bật
|
|
Lưu huỳnh (S)
|
-2, +4, +6
|
Linh hoạt và đa dạng hóa trị
|
|
Oxy (O)
|
-2
|
Không có hóa trị dương
|
|
Selenium (Se)
|
-2, 0, +4, +6
|
Hóa trị không ổn định
|
|
Tellurium (Te)
|
-2, 0, +4, +6
|
Hóa trị tương tự như selenium
|
Cấu hình electron liên quan tới hóa trị của lưu huỳnh
Phân tích cấu hình electron của S giúp chúng ta hiểu rõ hơn về khả năng hình thành hóa trị của nguyên tố này trong các phản ứng hóa học. Cấu hình electron của lưu huỳnh được mô tả như sau: 1s² 2s² 2p⁶ 3s² 3p⁴. Điều này cho thấy rằng S có 6 electron ở lớp ngoài cùng (n=3), trong đó 2 electron ở orbital s và 4 electron ở orbital p.
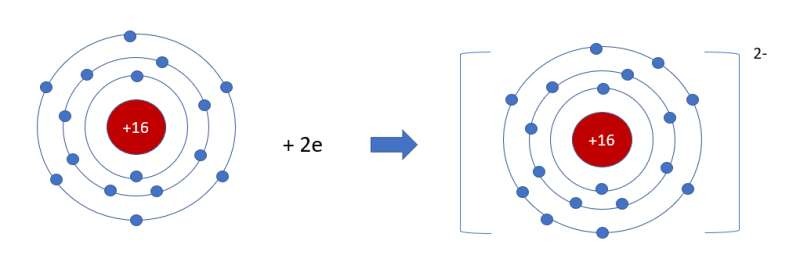
Cấu hình electron liên quan tới hóa trị của lưu huỳnh
Sự bố trí này tạo ra khả năng cho lưu huỳnh tương tác và chia sẻ electron trong các phản ứng hóa học để đạt được cấu hình bền của các khí hiếm, thường có 8 electron trong lớp vỏ ngoài cùng. Điều này cho phép S có thể tham gia vào các phản ứng oxi hóa-khử một cách linh hoạt, tạo ra những hợp chất đa dạng và phong phú.
Sự tương tác này giống như một vũ công trong một buổi biểu diễn nghệ thuật: tùy vào từng điệu nhảy, họ sẽ thay đổi cách thức di chuyển để hòa hợp với âm nhạc và môi trường xung quanh. S có thể "nhảy múa" từ hóa trị này sang hóa trị khác, đáp ứng linh hoạt với những yếu tố tác động bên ngoài.
Tính chất lý hóa của lưu huỳnh
Lưu huỳnh, một nguyên tố phi kim, không chỉ có ý nghĩa về hóa trị mà còn được đặc trưng bởi một số tính chất lý hóa khá đặc biệt. Dưới đây là một số tính chất chính của lưu huỳnh:
-
Dạng thù hình: Lưu huỳnh có hai dạng tồn tại chính là lưu huỳnh đơn tà (Sα) và lưu huỳnh đơn tà phương (Sβ). S đơn tà có nhiệt độ nóng chảy khoảng 113°C và nhiệt độ sôi từ 95.5 đến 119°C, trong khi lưu huỳnh đơn tà phương có nhiệt độ nóng chảy khoảng 119°C.
-
Tính chất vật lý: Lưu huỳnh là chất rắn kết tinh với màu vàng nhạt đến vàng sáng, không mùi và không vị. Khối lượng riêng của Sα khoảng 2.07 g/cm³, còn Sβ là khoảng 1.96 g/cm³. S còn có độ âm điện là 2.58, cho thấy khả năng của nguyên tố này trong việc tạo ra các liên kết hóa học.
-
Tính chất hóa học: Lưu huỳnh thể hiện cả tính oxi hóa và tính khử. Trong các phản ứng hóa học, số oxi hóa của S có thể thay đổi từ -2 đến +6, cho phép nó tạo ra nhiều loại hợp chất khác nhau, từ sulfide cho đến axit mạnh như axit sunfuric.
Ứng dụng của hóa trị S lưu huỳnh trong công nghiệp
Lưu huỳnh không chỉ là một nguyên tố hóa học, mà còn là một phần không thể thiếu trong nhiều quá trình sản xuất công nghiệp và hóa học. Dưới đây là một số ứng dụng tiêu biểu của lưu huỳnh trong ngành công nghiệp:

Lưu huỳnh có nhiều ứng dụng trong cuộc sống
Sản xuất axit sunfuric
Khoảng 90% lưu huỳnh được sử dụng để sản xuất axit sunfuric (H₂SO₄), một trong những hóa chất quan trọng nhất trong công nghiệp. Axit này được dùng trong sản xuất phân bón, chất tẩy rửa, nhiều quy trình công nghiệp khác.
Lưu hóa cao su
Khoảng 10% S còn lại được sử dụng trong quá trình lưu hóa cao su. Lưu hóa cao su góp phần cải thiện độ bền và tính chất của cao su, được ứng dụng trong sản xuất lốp xe, dây đai, các sản phẩm cao su khác.
Sản xuất diêm và các chất hóa học khác
Lưu huỳnh cũng được sử dụng để sản xuất diêm, các chất tẩy trắng, phẩm nhuộm, trong ngành dược phẩm. Điều này cho thấy vai trò đa dạng của S không chỉ trong lĩnh vực hóa học mà còn cả trong nhu cầu đời sống hàng ngày.
Ứng dụng trong hóa học phân tích
Hóa trị của lưu huỳnh cũng được ứng dụng trong nhiều phản ứng phân tích trong hóa học, phục vụ cho việc xác định các thành phần hóa học có mặt trong mẫu phân tích.
Tóm lại, lưu huỳnh không chỉ là một nguyên tố hóa học với ký hiệu S và số nguyên tử 16, mà còn là một phần cốt lõi trong nhiều phản ứng hóa học và quy trình sản xuất công nghiệp. Hóa trị đa dạng của nó từ -2 đến +6 cho phép lưu huỳnh linh hoạt tham gia vào nhiều loại hợp chất, từ sulfide đơn giản đến axit sunfuric phức tạp.
Hi vọng bài viết đã giúp các bạn có câu trả lời cho thắc mắc lưu huỳnh S hóa trị mấy. Thường xuyên theo dõi website dongachem.vn để cập nhật thêm nhiều thông tin bổ ích khác nữa các bạn nhé!