Khí lý tưởng là một khái niệm khoa học chủ chốt trong vật lý và hóa học, đóng vai trò quan trọng trong việc mô tả hành vi của các chất khí trong những điều kiện nhất định. Nếu bạn đã từng đặt câu hỏi về cách mà các khí chuyển động và tương tác với nhau trong không gian, thì khí lý tưởng sẽ đưa ra câu trả lời hoàn hảo cho thắc mắc đó. Hãy cùng dongachem.vn khám phá khí lý tưởng là gì, đặc điểm, ứng dụng trong thực tế của loại khí này.
Giải đáp khí lý tưởng là gì?
Khí lý tưởng là một mô hình lý tưởng hóa về một chất khí, được sử dụng rộng rãi trong nhiệt động lực học để đơn giản hóa các tính toán và phân tích. Khí lý tưởng được giả định là tuân theo một số điều kiện nhất định, cho phép chúng ta xây dựng các phương trình toán học mô tả hành vi của khí một cách chính xác.
Giải đáp khí lý tưởng là gì?
Các đặc tính của khí lý tưởng:
-
Các phân tử khí có kích thước rất nhỏ so với khoảng cách giữa chúng: Điều này có nghĩa là thể tích của các phân tử khí có thể bỏ qua so với thể tích của toàn bộ khí.
-
Các phân tử khí không tương tác với nhau: Các phân tử khí chỉ va chạm đàn hồi với nhau và với thành bình chứa, không có lực hút hoặc đẩy giữa các phân tử.
-
Năng lượng của khí lý tưởng chỉ là động năng: Năng lượng của khí lý tưởng chỉ phụ thuộc vào vận tốc chuyển động của các phân tử, không có năng lượng thế.
Tại sao gọi là khí lý tưởng?
-
Tính lý tưởng: Mô hình khí lý tưởng là một lý tưởng hóa, nghĩa là nó đơn giản hóa các tương tác phức tạp giữa các phân tử khí trong thực tế.
-
Dễ tính toán: Các phương trình mô tả trạng thái của khí lý tưởng (như phương trình trạng thái khí lý tưởng) có dạng toán học đơn giản, giúp việc tính toán trở nên dễ dàng hơn.
-
Ứng dụng rộng rãi: Mặc dù là một mô hình lý tưởng, khí lý tưởng vẫn được sử dụng rộng rãi để mô tả hành vi của nhiều loại khí thực ở điều kiện nhiệt độ và áp suất không quá cao.
Lưu ý: Không có khí nào hoàn toàn là khí lý tưởng trong thực tế. Tuy nhiên, ở điều kiện nhiệt độ và áp suất không quá cao, nhiều loại khí thực có thể coi gần đúng là khí lý tưởng.
Phương trình trạng thái của khí lý tưởng
Phương trình trạng thái của khí lý tưởng là một phương trình mô tả mối quan hệ giữa các đại lượng áp suất (p), thể tích (V) và nhiệt độ tuyệt đối (T) của một lượng khí lý tưởng. Nó được biểu diễn dưới dạng:
pV = nRT
Trong đó:
-
p: Áp suất của khí (thường đo bằng Pascal)
-
V: Thể tích của khí (thường đo bằng mét khối)
-
n: Số mol của khí
-
R: Hằng số khí lý tưởng (8.314 J/mol.K)
-
T: Nhiệt độ tuyệt đối của khí (đo bằng Kelvin)
Ý nghĩa của phương trình:
Phương trình này cho thấy rằng, đối với một lượng khí lý tưởng nhất định, tích của áp suất và thể tích tỉ lệ thuận với nhiệt độ tuyệt đối. Điều này có nghĩa là:
-
Nếu nhiệt độ tăng: Khi nhiệt độ tăng lên, các phân tử khí chuyển động nhanh hơn, va chạm mạnh hơn vào thành bình, dẫn đến áp suất tăng hoặc thể tích tăng (nếu áp suất được giữ không đổi).
-
Nếu thể tích giảm: Khi thể tích giảm, mật độ phân tử khí tăng lên, các phân tử va chạm với nhau và thành bình thường xuyên hơn, dẫn đến áp suất tăng.
Các dạng biến đổi của phương trình:
Ứng dụng của phương trình:
Phương trình trạng thái của khí lý tưởng được sử dụng rộng rãi trong các lĩnh vực như:
-
Vật lý: Nghiên cứu về khí, nhiệt động lực học.
-
Hóa học: Tính toán các đại lượng liên quan đến khí trong các phản ứng hóa học.
-
Kỹ thuật: Thiết kế các thiết bị sử dụng khí, như động cơ đốt trong, máy nén khí...
Các định luật liên quan đến khí lý tưởng
Khí lý tưởng là một mô hình lý tưởng hóa về chất khí, được sử dụng để đơn giản hóa các tính toán trong nhiệt động lực học. Các định luật về khí lý tưởng giúp chúng ta hiểu rõ hơn về mối quan hệ giữa các đại lượng áp suất (p), thể tích (V) và nhiệt độ tuyệt đối (T) của một lượng khí lý tưởng.

Các định luật liên quan đến khí lý tưởng
1. Định luật Boyle-Mariotte:
-
Nội dung: Ở nhiệt độ không đổi, áp suất của một lượng khí xác định tỉ lệ nghịch với thể tích của nó.
-
Biểu thức: pV = hằng số (khi T = hằng số)
-
Ý nghĩa: Khi nén một lượng khí ở nhiệt độ không đổi, áp suất của khí sẽ tăng lên và ngược lại.
-
Đồ thị: Đường đẳng nhiệt (đường biểu diễn sự biến thiên của áp suất theo thể tích khi nhiệt độ không đổi) là một đường hyperbol.
2. Định luật Gay-Lussac:
-
Nội dung: Ở áp suất không đổi, thể tích của một lượng khí xác định tỉ lệ thuận với nhiệt độ tuyệt đối của nó.
-
Biểu thức: V/T = hằng số (khi p = hằng số)
-
Ý nghĩa: Khi tăng nhiệt độ của một lượng khí ở áp suất không đổi, thể tích của khí sẽ tăng lên và ngược lại.
-
Đồ thị: Đường đẳng áp (đường biểu diễn sự biến thiên của thể tích theo nhiệt độ khi áp suất không đổi) là một đường thẳng đi qua gốc tọa độ.
3. Định luật Charles:
-
Nội dung: Ở thể tích không đổi, áp suất của một lượng khí xác định tỉ lệ thuận với nhiệt độ tuyệt đối của nó.
-
Biểu thức: p/T = hằng số (khi V = hằng số)
-
Ý nghĩa: Khi tăng nhiệt độ của một lượng khí ở thể tích không đổi, áp suất của khí sẽ tăng lên và ngược lại.
-
Đồ thị: Đường đẳng tích (đường biểu diễn sự biến thiên của áp suất theo nhiệt độ khi thể tích không đổi) là một đường thẳng đi qua gốc tọa độ.
4. Phương trình trạng thái của khí lý tưởng:
-
Biểu thức: pV = nRT
-
Ý nghĩa: Phương trình này tổng hợp ba định luật trên, cho phép tính toán các đại lượng p, V, T và n của một lượng khí lý tưởng.
Khi nào mô hình khí lý tưởng không còn phù hợp?
Mô hình khí lý tưởng là một mô hình đơn giản hóa, giúp chúng ta hiểu rõ hơn về hành vi của chất khí. Tuy nhiên, nó có những giới hạn nhất định và không áp dụng được cho tất cả các trường hợp.
Mô hình khí lý tưởng trở nên không phù hợp khi:
Các trường hợp khí thực thường không tuân theo định luật khí lý tưởng:
-
Khí gần điểm hóa lỏng: Khi khí gần nhiệt độ hóa lỏng, lực tương tác giữa các phân tử trở nên rất lớn, làm cho khí không còn tuân theo định luật khí lý tưởng.
-
Khí ở áp suất rất thấp: Ở áp suất rất thấp, mật độ phân tử khí rất nhỏ, dẫn đến các hiệu ứng lượng tử trở nên quan trọng.
So sánh giữa khí lý tưởng và khí thực
Khí lý tưởng và khí thực là hai khái niệm thường được sử dụng trong nhiệt động lực học để mô tả hành vi của chất khí. Mặc dù cả hai đều dùng để mô tả chất khí, nhưng chúng có những đặc điểm và ứng dụng khác nhau.
Khí lý tưởng
-
Mô hình lý tưởng hóa: Khí lý tưởng là một mô hình lý tưởng hóa, trong đó các phân tử khí được coi là các điểm vật lý không có kích thước và không tương tác với nhau ngoại trừ các va chạm đàn hồi hoàn toàn.
-
Phương trình trạng thái: Tuân theo phương trình trạng thái khí lý tưởng: pV = nRT
-
Ưu điểm: Mô hình đơn giản, dễ sử dụng để tính toán và giải thích các hiện tượng liên quan đến khí.
-
Hạn chế: Chỉ đúng trong điều kiện nhiệt độ cao và áp suất thấp, khi các tương tác giữa các phân tử khí có thể bỏ qua.
Khí thực
-
Mô hình gần với thực tế: Khí thực là các chất khí tồn tại trong thực tế, chúng có kích thước và tương tác với nhau.
-
Phương trình trạng thái: Không tuân theo chính xác phương trình trạng thái khí lý tưởng, cần sử dụng các phương trình trạng thái phức tạp hơn như phương trình van der Waals để mô tả chính xác hơn.
-
Ưu điểm: Mô tả chính xác hơn hành vi của khí trong các điều kiện thực tế.
-
Hạn chế: Các phương trình trạng thái của khí thực thường phức tạp hơn và khó giải.
Bảng so sánh chi tiết:
|
Đặc điểm
|
Khí lý tưởng
|
Khí thực
|
|
Kích thước phân tử
|
Không có kích thước
|
Có kích thước
|
|
Tương tác giữa các phân tử
|
Không có tương tác
|
Có tương tác (hút và đẩy)
|
|
Phương trình trạng thái
|
pV = nRT
|
Phương trình van der Waals hoặc các phương trình phức tạp hơn
|
|
Ứng dụng
|
Sử dụng để tính toán gần đúng trong các điều kiện nhiệt độ và áp suất không quá cao
|
Sử dụng để tính toán chính xác trong các điều kiện thực tế
|
Việc lựa chọn sử dụng mô hình khí lý tưởng hay khí thực phụ thuộc vào từng trường hợp cụ thể và độ chính xác yêu cầu của bài toán. Hiểu rõ sự khác biệt giữa hai mô hình này giúp chúng ta lựa chọn được mô hình phù hợp để giải quyết các bài toán liên quan đến chất khí.
Ứng dụng thực tiễn của khí lý tưởng
Mặc dù khí lý tưởng là một mô hình lý tưởng hóa, nó vẫn được ứng dụng rộng rãi trong nhiều lĩnh vực của cuộc sống và khoa học kỹ thuật. Dưới đây là một số ví dụ điển hình:
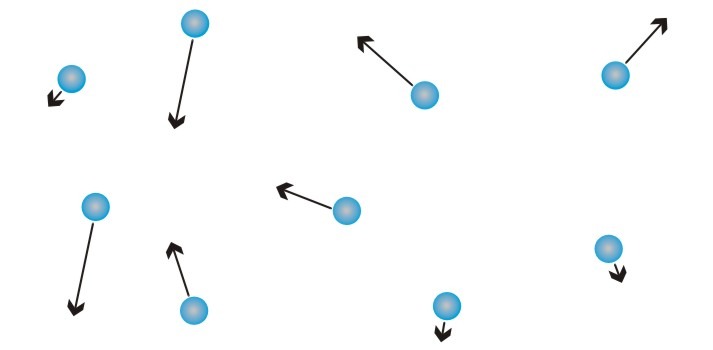
Khí lý tưởng có nhiều ứng dụng thực tiễn
1. Ngành công nghiệp:
-
Động cơ đốt trong: Phương trình trạng thái của khí lý tưởng giúp tính toán áp suất, thể tích và nhiệt độ của hỗn hợp khí cháy trong động cơ, từ đó tối ưu hóa hiệu suất động cơ.
-
Máy nén khí: Quá trình nén khí trong máy nén khí tuân theo định luật Boyle-Mariotte. Hiểu rõ nguyên lý này giúp thiết kế các máy nén khí hiệu quả.
-
Bình chứa khí: Việc tính toán áp suất và thể tích của khí trong bình chứa khí dựa trên phương trình trạng thái của khí lý tưởng.
2. Khí tượng:
-
Dự báo thời tiết: Các mô hình dự báo thời tiết sử dụng phương trình trạng thái của khí lý tưởng để mô phỏng sự chuyển động của khối khí trong khí quyển.
-
Nghiên cứu khí hậu: Hiểu rõ hành vi của khí quyển giúp các nhà khoa học nghiên cứu biến đổi khí hậu và các hiện tượng thời tiết cực đoan.
3. Hóa học:
-
Tính toán lượng chất khí: Trong các phản ứng hóa học sinh ra khí, phương trình trạng thái giúp tính toán thể tích khí thu được.
-
Phân tích khí: Phương pháp sắc ký khí sử dụng khí lý tưởng làm pha động để tách các chất khí.
4. Lặn:
5. Khí cầu:
6. Các lĩnh vực khác:
-
Công nghiệp thực phẩm: Sử dụng trong quá trình đóng gói các sản phẩm khí hóa.
-
Y học: Trong một số thiết bị y tế như máy thở, máy đo huyết áp.
-
Nghiên cứu vũ trụ: Nghiên cứu hành vi của khí trong môi trường không trọng lực.
Khí lý tưởng, với tất cả những đặc điểm và ứng dụng thực tiễn của mình, là một khái niệm không thể thiếu trong thế giới vật lý và hóa học. Dù được xây dựng dựa trên những giả định lý tưởng, khí lý tưởng lại mang đến những hiểu biết quan trọng giúp chúng ta nghiên cứu và giải thích nhiều hiện tượng trong cuộc sống hàng ngày.
Dongachem.vn hi vọng rằng qua bài viết này các bạn đã hiểu rõ hơn về khí lý tưởng là gì cũng như những ứng dụng trong cuộc sống.