Hợp chất lưỡng tính, một khái niệm thú vị trong hóa học, chính là những chất có khả năng phản ứng với cả axit và bazơ. Đặc điểm này mang đến cho chúng một vai trò hết sức quan trọng trong nhiều quá trình hóa học, sinh học và công nghiệp. Bạn có biết rằng nước, chất mà chúng ta gọi là "mạch sống" của hành tinh, cũng là một hợp chất lưỡng tính? Sự hiện hữu của hợp chất lưỡng tính không chỉ đơn giản là lý thuyết; chúng có ứng dụng thiết thực trong cuộc sống hàng ngày, từ xử lý nước đến y học. Hãy cùng tìm hiểu sâu hơn về hợp chất lưỡng tính là gì để khám phá những điều kỳ diệu mà chúng mang lại.
Định nghĩa hợp chất lưỡng tính là gì?
Hợp chất lưỡng tính là những chất có khả năng thể hiện cả tính axit và tính bazơ, tùy thuộc vào điều kiện môi trường. Nói cách khác, chúng có thể cho hoặc nhận proton (H+) trong các phản ứng hóa học.
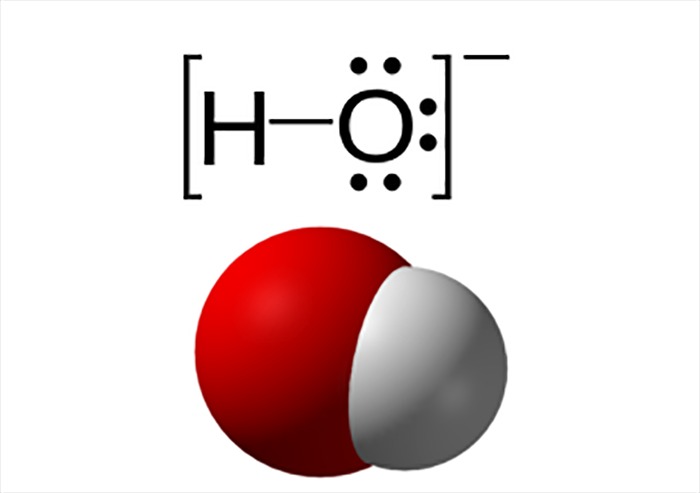
Định nghĩa hợp chất lưỡng tính là gì?
Tính chất đặc trưng
-
Tính lưỡng cực: Đây là đặc điểm nổi bật nhất của hợp chất lưỡng tính. Chúng có thể phản ứng với cả acid và base để tạo thành muối.
-
Phụ thuộc vào môi trường: Tính axit hoặc bazơ của hợp chất lưỡng tính thường phụ thuộc vào pH của dung dịch.
-
Cấu trúc phân tử: Thường có chứa các nguyên tử có nhiều trạng thái oxy hóa khác nhau hoặc các nhóm chức có thể đóng vai trò cả cho và nhận proton.
Ví dụ về hợp chất lưỡng tính
-
Các hidroxit lưỡng tính:
-
Nhôm hidroxit (Al(OH)₃): Trong môi trường axit, nó tác dụng như một bazơ, tạo thành muối nhôm. Trong môi trường bazơ, nó tác dụng như một axit, tạo thành aluminat.
-
Kẽm hidroxit (Zn(OH)₂): Tương tự như nhôm hidroxit, kẽm hidroxit cũng thể hiện tính lưỡng tính.
-
Các oxit lưỡng tính:
Nhôm oxit (Al₂O₃): Phản ứng với cả axit và bazơ tạo thành muối.
-
Các amino axit: Đây là những hợp chất hữu cơ chứa cả nhóm amino (có tính bazơ) và nhóm carboxyl (có tính axit).
-
Nước (H₂O): Trong một số phản ứng, nước có thể thể hiện tính axit hoặc bazơ.
Cơ chế phản ứng của hợp chất lưỡng tính
-
Với axit: Hợp chất lưỡng tính đóng vai trò như một bazơ, nhận proton từ axit để tạo thành muối và nước. Ví dụ: Al(OH)₃ + 3HCl → AlCl₃ + 3H₂O
-
Với bazơ: Hợp chất lưỡng tính đóng vai trò như một axit, cho proton cho bazơ để tạo thành muối và nước. Ví dụ: Al(OH)₃ + NaOH → NaAlO₂ + 2H₂O
Lý do tồn tại tính lưỡng tính
Tính lưỡng tính của một hợp chất thường liên quan đến:
-
Cấu trúc điện tử: Sự phân bố electron trong phân tử, sự có mặt của các cặp electron tự do.
-
Ảnh hưởng của môi trường: pH của dung dịch, sự có mặt của các ion khác có thể ảnh hưởng đến tính chất của hợp chất.
Các loại hợp chất lưỡng tính
Hợp chất lưỡng tính là những chất có thể thể hiện cả tính axit và tính bazơ, tùy thuộc vào điều kiện môi trường. Chúng đóng vai trò quan trọng trong nhiều phản ứng hóa học và có ứng dụng rộng rãi trong công nghiệp. Dưới đây là một số loại hợp chất lưỡng tính thường gặp:
1. Hidroxit lưỡng tính:
Đây là những hydroxide của một số kim loại chuyển tiếp, chúng có khả năng phản ứng với cả axit và bazơ.
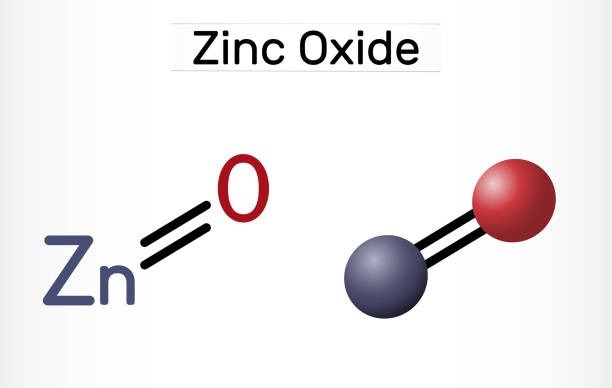
2. Oxit lưỡng tính:
Oxit lưỡng tính
Là các oxit của kim loại có thể phản ứng với cả axit và bazơ tạo thành muối và nước.
-
Ví dụ: Al₂O₃, ZnO, SnO
-
Phản ứng:
3. Amino axit:
-
Cấu trúc: Là những hợp chất hữu cơ chứa cả nhóm amino (–NH₂) có tính bazơ và nhóm cacboxyl (–COOH) có tính axit.
-
Tính chất: Trong dung dịch, amino axit tồn tại ở dạng ion lưỡng cực, vừa mang điện tích dương (ở nhóm amino) và điện tích âm (ở nhóm cacboxyl).
-
Ví dụ: Glyxin (H₂NCH₂COOH), alanin (CH₃CH(NH₂)COOH)
4. Một số muối:
-
Muối axit: Các muối axit của các axit yếu có thể thể hiện tính bazơ. Ví dụ: NaHCO₃, NaH₂PO₄.
-
Muối của các kim loại lưỡng tính: Ví dụ: Zn(OH)Cl.
Ứng dụng của hợp chất lưỡng tính là gì?
Hợp chất lưỡng tính, với khả năng thể hiện cả tính axit và bazơ, đã tìm thấy nhiều ứng dụng quan trọng trong cuộc sống và công nghiệp. Dưới đây là một số ứng dụng điển hình:

Hợp chất lưỡng tính có nhiều ứng dụng trong cuộc sống
1. Trong Công Nghiệp:
-
Sản xuất vật liệu:
-
Xi măng: Các hợp chất lưỡng tính như nhôm hydroxide đóng vai trò quan trọng trong quá trình đông cứng của xi măng, tạo ra các liên kết bền vững giữa các hạt xi măng.
-
Gốm sứ: Một số oxit lưỡng tính được sử dụng làm chất phụ gia để cải thiện tính chất của gốm sứ.
-
Xử lý nước: Hợp chất lưỡng tính được sử dụng để điều chỉnh độ pH của nước, loại bỏ các ion kim loại nặng và các chất ô nhiễm khác.
-
Sản xuất pin: Một số hidroxit lưỡng tính được sử dụng làm chất điện phân trong pin.
-
Sản xuất chất tẩy rửa: Một số hợp chất lưỡng tính được sử dụng làm chất hoạt động bề mặt trong các sản phẩm tẩy rửa.
2. Trong Hóa Học:
-
Chất xúc tác: Nhiều hợp chất lưỡng tính được sử dụng làm chất xúc tác trong các phản ứng hóa học.
-
Chất đệm: Chúng có thể được sử dụng để tạo ra các dung dịch đệm, duy trì độ pH ổn định.
-
Hóa phân tích: Dùng để xác định nồng độ của các ion kim loại.
3. Trong Sinh Học:
-
Amino axit: Là đơn vị cấu tạo nên protein, có tính lưỡng tính, giúp protein có thể tạo ra các cấu trúc phức tạp và thực hiện nhiều chức năng sinh học.
-
Enzyme: Nhiều enzyme có chứa các nhóm chức lưỡng tính, giúp chúng xúc tác cho các phản ứng sinh hóa.
4. Trong Y học:
-
Thuốc kháng acid: Một số hợp chất lưỡng tính được sử dụng để trung hòa axit dạ dày, điều trị chứng ợ chua.
-
Chất bảo quản: Một số hợp chất lưỡng tính được sử dụng làm chất bảo quản trong thực phẩm và dược phẩm.
5. Trong Môi Trường:
Sự khác biệt giữa hợp chất lưỡng tính và hợp chất khác
Hợp chất lưỡng tính là một loại hợp chất đặc biệt, có khả năng thể hiện cả tính axit và tính bazơ, tùy thuộc vào điều kiện môi trường. Để hiểu rõ hơn về sự khác biệt giữa hợp chất lưỡng tính và các hợp chất khác, chúng ta cùng phân tích sâu hơn.
1. Định nghĩa:
-
Hợp chất lưỡng tính: Là hợp chất có thể cho hoặc nhận proton (H+) trong các phản ứng hóa học, tùy thuộc vào môi trường.
-
Axit: Là chất cho proton.
-
Bazơ: Là chất nhận proton.
2. Cấu trúc:
-
Hợp chất lưỡng tính: Thường có cấu trúc phân tử đặc biệt, chứa các nhóm chức có thể đóng vai trò cả cho và nhận proton. Ví dụ: nhôm hidroxit (Al(OH)₃) có cả nhóm hydroxyl (-OH) có thể cho proton và nhận proton.
-
Axit: Thường chứa nguyên tử hydro liên kết với nguyên tử phi kim có độ âm điện cao.
-
Bazơ: Thường chứa nhóm hydroxyl (OH-) hoặc ion hydroxit (OH⁻).
3. Tính chất:
|
Tính chất
|
Hợp chất lưỡng tính
|
Axit
|
Bazơ
|
|
Khả năng cho/nhận proton
|
Cả cho và nhận
|
Chỉ cho
|
Chỉ nhận
|
|
Phản ứng với nước
|
Tùy thuộc vào pH
|
Tạo H₃O⁺
|
Tạo OH⁻
|
|
Phản ứng với kim loại
|
Có thể phản ứng với một số kim loại
|
Phản ứng với nhiều kim loại
|
Ít phản ứng với kim loại
|
|
Phản ứng với muối
|
Có thể phản ứng với nhiều loại muối
|
Phản ứng với bazơ tạo muối và nước
|
Phản ứng với axit tạo muối và nước
|
4. Ví dụ:
5. Ứng dụng:
-
Hợp chất lưỡng tính: Được sử dụng trong nhiều lĩnh vực như sản xuất vật liệu xây dựng, hóa chất, dược phẩm.
-
Axit: Sử dụng trong sản xuất phân bón, chất tẩy rửa, thực phẩm.
-
Bazơ: Sử dụng trong sản xuất giấy, xà phòng, pin.
6. Bản chất:
Các yếu tố ảnh hưởng tới hợp chất lưỡng tính
Khi nghiên cứu về hợp chất lưỡng tính, có nhiều yếu tố có thể tác động đến tính chất và khả năng phản ứng của hợp chất này. Để hiểu rõ hơn, chúng ta hãy điểm qua một số yếu tố quan trọng nhất:
Có nhiều yếu tố ảnh hưởng tới tính chất của hợp chất lưỡng tính
-
Điện tích hạt nhân: Càng cao, khả năng cho hoặc nhận proton của hợp chất càng mạnh mẽ. Các hợp chất có hạt nhân mang điện tích cao thường có nhu cầu tương tác mạnh và dễ dàng hơn với các proton.
-
Cấu trúc phân tử: Sự phân cực trong cấu trúc phân tử cũng đóng vai trò quan trọng. Cấu trúc không đối xứng thường tạo ra độ phân cực, giúp hợp chất lưỡng tính hoạt động linh hoạt hơn khi tham gia vào các phản ứng hóa học.
-
Số oxi hóa của kim loại: Các kim loại có số oxi hóa cao thường dễ tạo ra hợp chất lưỡng tính vì chúng có khả năng nhường electron dễ dàng hơn. Điều này góp phần làm tăng khả năng phản ứng với axit và bazơ.
-
Mức độ pH của môi trường: Mức độ pH thích hợp có thể ảnh hưởng đến khả năng cạnh tranh của hợp chất, với tính axit hoặc bazơ có thể chiếm ưu thế tuỳ thuộc vào điều kiện cụ thể. Một pH quá cao hoặc quá thấp có thể làm giảm khả năng của hợp chất lưỡng tính trong phản ứng.
-
Áp suất và nhiệt độ: Hai yếu tố này cũng có thể ảnh hưởng đến tốc độ phản ứng của hợp chất lưỡng tính, làm tăng hoặc giảm khả năng tương tác với axit và bazơ.
Tất cả những yếu tố này không chỉ biểu hiện sự tương tác hóa học mà còn giúp chúng ta hiểu rõ hơn về cách mà hợp chất lưỡng tính hoạt động trong môi trường đa dạng của cuộc sống hàng ngày.
Qua bài viết trên của dongachem.vn có thể thấy hợp chất lưỡng tính không chỉ là một khái niệm thú vị trong hóa học mà còn thực sự có ý nghĩa vô cùng quan trọng trong cuộc sống hàng ngày và trong nhiều lĩnh vực như y học, nông nghiệp và công nghiệp. Sự linh hoạt của chúng cho phép tham gia vào các phản ứng hóa học phức tạp mà không bị giới hạn, giúp hình thành môi trường pH cân bằng và ổn định. Từ nước, nhôm hydroxit đến các ion cơ bản, các hợp chất lưỡng tính mở ra nhiều cánh cửa cho các nghiên cứu khoa học và ứng dụng thực tiễn. Việc hiểu rõ hợp chất lưỡng tính là gì, nghiên cứu và áp dụng hợp chất lưỡng tính sẽ không ngừng giúp chúng ta khám phá những điều kỳ diệu khác của thế giới hóa học.