Hằng số cân bằng (Kc) là một khái niệm thiết yếu trong hóa học, đại diện cho tỷ lệ giữa nồng độ của các sản phẩm và chất phản ứng trong một phản ứng thuận nghịch khi đạt đến trạng thái cân bằng. Việc hiểu và áp dụng hằng số cân bằng không chỉ giúp các nhà khoa học và kỹ sư hóa học dự đoán hành vi của các phản ứng hóa học, mà còn ứng dụng trong nhiều lĩnh vực công nghiệp khác nhau. Bài viết này Đông Á Chemical sẽ đi sâu vào khái niệm, biểu thức, ý nghĩa và các yếu tố ảnh hưởng đến hằng số cân bằng, cũng như ứng dụng trong công nghiệp và ảnh hưởng của nhiệt độ đến giá trị của hằng số cân bằng.
Khái niệm về hằng số cân bằng
Hằng số cân bằng (K) là một giá trị số đặc trưng cho một phản ứng hóa học ở một nhiệt độ nhất định. Nó cho biết mức độ phản ứng thuận nghịch diễn ra đến đâu, tức là phản ứng có ưu tiên chuyển dịch về phía sản phẩm hay chất phản ứng.
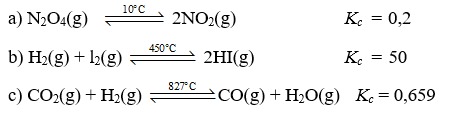
Ví dụ minh họa cho hằng số cân bằng của một số phản ứng
Hiểu rõ hơn về cân bằng hóa học
Khi một phản ứng hóa học xảy ra, các chất tham gia phản ứng liên tục biến đổi thành sản phẩm và ngược lại. Khi tốc độ của hai quá trình này bằng nhau, hệ đạt đến trạng thái cân bằng hóa học.
Đặc điểm của cân bằng hóa học
Biểu thức hằng số cân bằng

Đây là một ví dụ về phương pháp tính hằng số cân bằng
Đối với một phản ứng hóa học tổng quát:
aA + bB ⇌ mM + nN
Trong đó:
Biểu thức hằng số cân bằng Kc được tính theo công thức:
Kc = ([M]m x [N]n) / ([A]a x [B]b)
Trong đó: [A], [B], [M], [N] là nồng độ mol/l của các chất A, B, M, N tại trạng thái cân bằng.
Các loại phản ứng và Kc
Bảng dưới đây là một số thông tin tổng hợp về loại phản ứng cùng đặc điểm của hằng số Kc.
|
Loại phản ứng
|
Biểu thức Kc
|
Kc
|
|
Phản ứng thuận lợi
|
(Kc > 1)
|
Nhiều sản phẩm hơn chất phản ứng
|
|
Phản ứng nghịch lợi
|
(Kc < 1)
|
Nhiều chất phản ứng hơn sản phẩm
|
|
Cân bằng hoàn hảo
|
(Kc = 1)
|
Sản phẩm và chất phản ứng tương đương
|
Như vậy, biểu thức hằng số cân bằng không chỉ là một công thức tính toán mà còn chứa đựng nhiều thông tin giá trị về bản chất của phản ứng. Sự đa dạng trong các biểu thức Kc khiến cho nó trở thành một phần không thể thiếu trong kho tàng kiến thức hóa học.
Ý nghĩa của hằng số cân bằng
Kc cho biết mức độ phản ứng thuận nghịch diễn ra đến đâu, tức là phản ứng có ưu tiên chuyển dịch về phía sản phẩm hay chất phản ứng. Ý nghĩa của hằng số cân bằng là:
-
Chỉ số về mức độ phản ứng:
-
Kc lớn: Phản ứng thuận diễn ra mạnh, ưu tiên tạo thành sản phẩm. Điều này có nghĩa là tại trạng thái cân bằng, nồng độ sản phẩm sẽ cao hơn nhiều so với nồng độ chất phản ứng.
-
Kc nhỏ: Phản ứng nghịch diễn ra mạnh, chất phản ứng chiếm ưu thế. Ngược lại với trường hợp trên, tại trạng thái cân bằng, nồng độ chất phản ứng sẽ cao hơn nhiều so với nồng độ sản phẩm.
-
Kc = 1: Phản ứng thuận nghịch diễn ra tương đương nhau. Nồng độ của chất phản ứng và sản phẩm tại trạng thái cân bằng xấp xỉ bằng nhau.
-
Dự báo chiều chuyển dịch của cân bằng:
-
Nếu hệ thống bị tác động (thay đổi nồng độ, áp suất, nhiệt độ), phản ứng sẽ tự điều chỉnh để đạt đến một trạng thái cân bằng mới. Giá trị của Kc giúp ta dự đoán chiều chuyển dịch của cân bằng để đạt được trạng thái cân bằng mới đó.
-
Tính toán nồng độ các chất tại trạng thái cân bằng:
-
Đánh giá hiệu suất phản ứng:
Các yếu tố ảnh hưởng đến hằng số cân bằng
Hằng số cân bằng (Kc) là một giá trị đặc trưng cho mỗi phản ứng hóa học ở một nhiệt độ nhất định. Tuy nhiên, Kc không phải là một hằng số tuyệt đối mà nó phụ thuộc vào một số yếu tố. Yếu tố duy nhất ảnh hưởng trực tiếp đến Kc là:
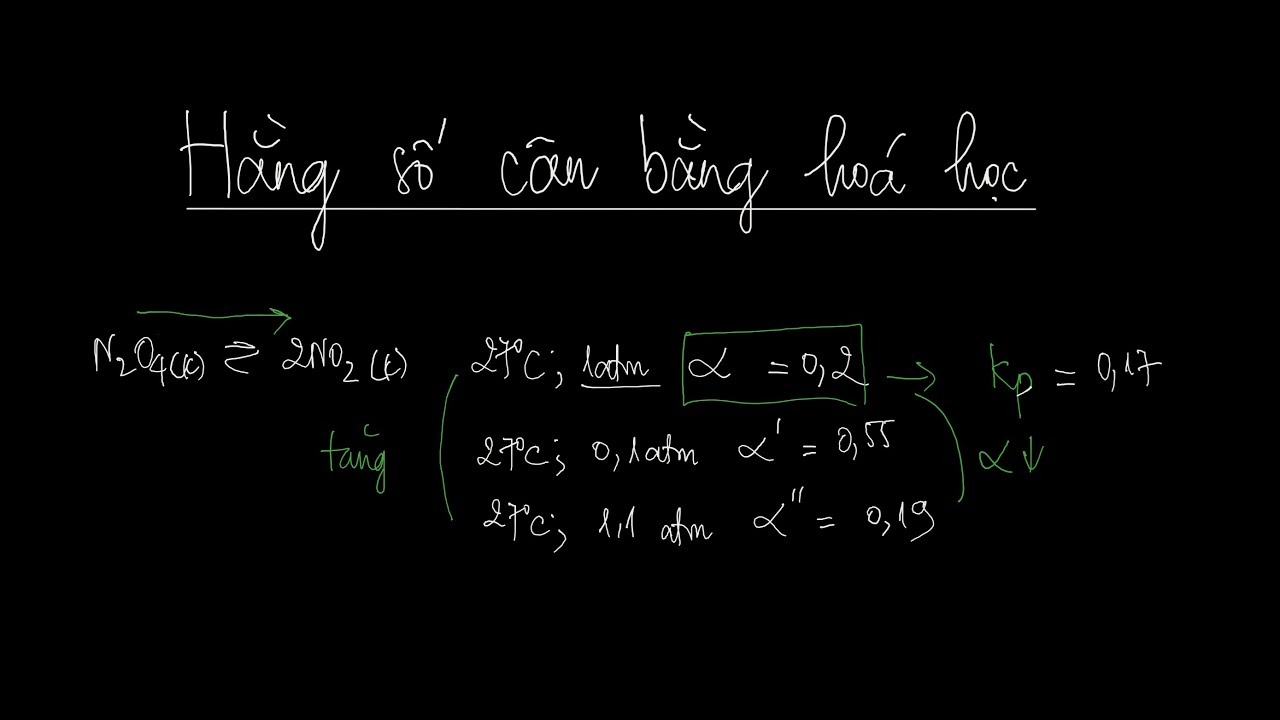
Hằng số cân bằng hóa học phụ thuộc vào yếu tố nhiệt độ
-
Nhiệt độ:
-
Phản ứng tỏa nhiệt: Khi tăng nhiệt độ, cân bằng sẽ chuyển dịch theo chiều thu nhiệt (nghĩa là ngược lại chiều của phản ứng tỏa nhiệt) để giảm nhiệt độ hệ thống. Do đó, Kc sẽ giảm.
-
Phản ứng thu nhiệt: Khi tăng nhiệt độ, cân bằng sẽ chuyển dịch theo chiều thu nhiệt (chiều của phản ứng) để hấp thụ thêm nhiệt. Do đó, Kc sẽ tăng.
Các yếu tố khác có thể làm thay đổi nồng độ các chất tham gia phản ứng, gián tiếp làm thay đổi tốc độ phản ứng thuận và nghịch, nhưng không làm thay đổi giá trị của Kc:
-
Nồng độ: Thay đổi nồng độ của một chất tham gia phản ứng sẽ làm chuyển dịch cân bằng theo chiều làm giảm sự thay đổi đó, nhưng không làm thay đổi giá trị của Kc.
-
Áp suất: Áp suất chỉ ảnh hưởng đến các phản ứng có chất khí tham gia. Khi tăng áp suất, cân bằng sẽ chuyển dịch theo chiều làm giảm số mol khí. Tuy nhiên, Kp (hằng số cân bằng tính theo áp suất) sẽ thay đổi, còn Kc vẫn không đổi.
-
Chất xúc tác: Chất xúc tác làm tăng tốc độ cả phản ứng thuận và nghịch như nhau, giúp hệ đạt đến trạng thái cân bằng nhanh hơn, nhưng không làm thay đổi giá trị của Kc.
Ứng dụng của hằng số cân bằng trong công nghiệp
Hằng số cân bằng (Kc) là một công cụ vô cùng hữu ích trong công nghiệp, đặc biệt trong các quá trình sản xuất hóa chất. Dựa vào giá trị của Kc, các nhà khoa học và kỹ sư có thể:
1. Điều khiển hiệu suất phản ứng:
-
Tối ưu hóa điều kiện phản ứng: Bằng cách điều chỉnh nhiệt độ, áp suất và nồng độ các chất tham gia, người ta có thể làm dịch chuyển cân bằng theo chiều có lợi, tăng hiệu suất phản ứng và giảm chi phí sản xuất.
-
Chọn lựa xúc tác: Chất xúc tác làm tăng tốc độ cả phản ứng thuận và nghịch nhưng không làm thay đổi giá trị Kc. Tuy nhiên, bằng cách chọn lựa chất xúc tác phù hợp, ta có thể tăng tốc độ đạt đến trạng thái cân bằng, từ đó rút ngắn thời gian sản xuất.
2. Thiết kế các quá trình sản xuất:
-
Lựa chọn công nghệ: Dựa vào giá trị Kc, người ta có thể đánh giá khả năng thực hiện một phản ứng hóa học trong điều kiện công nghiệp. Nếu Kc lớn, phản ứng thuận được ưu tiên và quá trình sản xuất sẽ dễ dàng hơn.
-
Xây dựng quy trình: Các thông số như nhiệt độ, áp suất, nồng độ được thiết kế dựa trên giá trị Kc để đảm bảo hiệu suất cao nhất và chi phí thấp nhất.
3. Giải quyết các vấn đề môi trường:
-
Giảm thiểu chất thải: Bằng cách điều chỉnh cân bằng hóa học, có thể giảm lượng chất thải và tăng hiệu quả sử dụng nguyên liệu.
-
Xử lý chất thải: Một số quá trình xử lý chất thải dựa trên nguyên tắc chuyển dịch cân bằng để biến đổi các chất độc hại thành các chất vô hại.
Các ví dụ cụ thể:
-
Sản xuất amoniac: Quá trình sản xuất amoniac (NH₃) từ N₂ và H₂ là một ví dụ điển hình. Bằng cách điều chỉnh nhiệt độ, áp suất và sử dụng xúc tác sắt, người ta đã tối ưu hóa quá trình này để sản xuất ra lượng lớn amoniac phục vụ cho sản xuất phân bón.
-
Sản xuất axit sulfuric: Quá trình sản xuất axit sulfuric cũng liên quan đến nhiều phản ứng cân bằng. Việc điều chỉnh các yếu tố như nhiệt độ, áp suất giúp tăng hiệu suất quá trình.
-
Xử lý nước thải: Trong quá trình xử lý nước thải, các phản ứng cân bằng được sử dụng để loại bỏ các chất ô nhiễm như kim loại nặng, chất hữu cơ.
Tóm lại, hằng số cân bằng Kc là một công cụ hữu ích giúp các nhà khoa học và kỹ sư hiểu rõ hơn về các quá trình hóa học và từ đó tối ưu hóa các quá trình sản xuất trong công nghiệp.
Tổng hợp những thông tin mà bài viết trên của Đông Á Chemical chia sẻ có thể hiểu về hằng số cân bằng, chúng ta có thể nhận thấy rằng Kc không chỉ đơn thuần là một khái niệm lý thuyết mà còn là một phần thiết yếu trong hệ thống hóa học và công nghiệp. Từ việc nắm bắt khái niệm, biểu thức, cho tới hiểu rõ các yếu tố ảnh hưởng và ứng dụng thực tiễn, hằng số cân bằng hiện hữu như một nhịp cầu vững chắc nối liền lý thuyết với thực hành. Việc hiểu và áp dụng hằng số cân bằng không chỉ giúp tối ưu hóa quy trình sản xuất mà còn nâng cao hiệu quả kinh tế, từ đó mở ra nhiều cơ hội sáng tạo trong khoa học và công nghệ.