Dung dịch đệm là một khái niệm quan trọng trong hóa học và sinh học, giúp duy trì sự ổn định của pH trong nhiều loại quá trình phản ứng. Nếu không có dung dịch đệm, sự thay đổi nhỏ trong môi trường có thể ảnh hưởng nghiêm trọng đến hoạt động của enzyme và các phản ứng hóa học. Hãy cùng Đông Á Chemical khám phá kỹ lưỡng về dung dịch đệm để hiểu rõ hơn về tầm quan trọng của nó trong cả lý thuyết và thực hành.
Định nghĩa dung dịch đệm là gì?
Dung dịch đệm là một loại dung dịch đặc biệt có khả năng duy trì độ pH gần như không đổi khi ta thêm vào một lượng nhỏ acid hoặc base. Nhờ tính chất này, dung dịch đệm đóng vai trò vô cùng quan trọng trong nhiều lĩnh vực, từ sinh học đến công nghiệp.

Định nghĩa dung dịch đệm là gì?
Thành phần của dung dịch đệm
Một dung dịch đệm thường bao gồm một cặp chất:
Tác dụng của dung dịch đệm
-
Duy trì độ pH ổn định: Đây là chức năng chính của dung dịch đệm. Khi thêm acid hoặc base vào dung dịch đệm, pH sẽ chỉ thay đổi rất ít so với ban đầu.
-
Bảo vệ các hệ thống sinh học: Trong cơ thể sống, dung dịch đệm giúp duy trì pH ổn định cho các quá trình sinh hóa diễn ra bình thường.
-
Điều chỉnh pH trong các quá trình công nghiệp: Dung dịch đệm được sử dụng để điều chỉnh pH trong các quá trình như lên men, mạ điện, sản xuất dược phẩm...
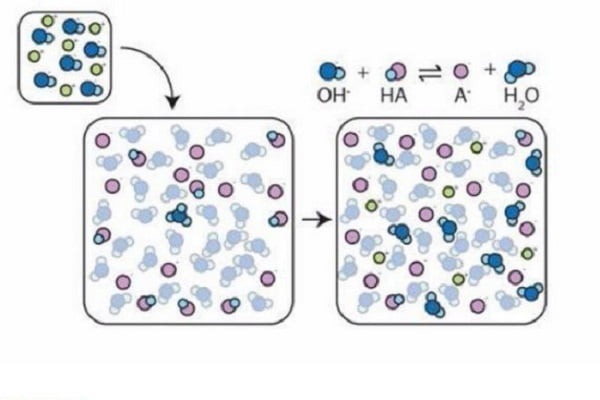
Cơ chế hoạt động của dung dịch đệm
Khi thêm acid vào dung dịch đệm, bazơ liên hợp sẽ trung hòa lượng H⁺ được thêm vào, giữ cho pH không giảm đáng kể. Ngược lại, khi thêm base vào, axit yếu sẽ trung hòa lượng OH⁻ được thêm vào, giữ cho pH không tăng quá nhiều.
Ví dụ:
-
Dung dịch đệm axit acetic (CH₃COOH) và natri acetat (CH₃COONa). Khi thêm NaOH vào dung dịch này, phản ứng trung hòa xảy ra: CH₃COOH + NaOH → CH₃COONa + H₂O
-
Ion acetat (CH₃COO⁻) từ muối sẽ kết hợp với H⁺ để tạo thành axit acetic, giúp duy trì pH.
Các loại dung dịch đệm
Dung dịch đệm là một hỗn hợp dung dịch gồm một axit yếu và muối của nó với một bazơ mạnh, hoặc một bazơ yếu và muối của nó với một axit mạnh. Chúng có khả năng duy trì độ pH gần như không đổi khi thêm vào một lượng nhỏ acid hoặc base. Dựa trên thành phần, dung dịch đệm có thể được chia thành hai loại chính:
1. Dung dịch đệm axit

Dung dịch đệm axit
-
Thành phần: Gồm một axit yếu và muối của nó với một bazơ mạnh.
-
Ví dụ: Dung dịch axit acetic (CH₃COOH) và natri acetat (CH₃COONa).
-
Cơ chế hoạt động: Khi thêm base vào, ion OH⁻ sẽ kết hợp với H⁺ từ axit yếu để tạo thành nước. Ion acetat (CH₃COO⁻) từ muối sẽ kết hợp với H⁺ được giải phóng từ axit yếu, giúp duy trì nồng độ H⁺ tương đối ổn định.
2. Dung dịch đệm bazơ

Dung dịch đệm bazơ
-
Thành phần: Gồm một bazơ yếu và muối của nó với một axit mạnh.
-
Ví dụ: Dung dịch amoniac (NH₃) và amoni clorua (NH₄Cl).
-
Cơ chế hoạt động: Khi thêm acid vào, ion H⁺ sẽ kết hợp với NH₃ để tạo thành NH₄⁺. Ion Cl⁻ từ muối sẽ không ảnh hưởng đến cân bằng.
Các loại dung dịch đệm thường gặp:
-
Dung dịch đệm phosphate: Được sử dụng rộng rãi trong sinh học và hóa sinh vì khả năng duy trì pH trong khoảng sinh lý.
-
Dung dịch đệm acetate: Được sử dụng trong nhiều ứng dụng phân tích hóa học.
-
Dung dịch đệm Tris: Được sử dụng trong các nghiên cứu sinh học phân tử.
-
Dung dịch đệm HEPES: Được sử dụng trong nuôi cấy tế bào và sinh hóa.
-
Dung dịch đệm bicarbonate: Là hệ đệm chính trong máu người.
Các yếu tố ảnh hưởng đến dung dịch đệm
Dung dịch đệm, như chúng ta đã biết, có vai trò quan trọng trong việc duy trì độ pH ổn định. Tuy nhiên, hiệu quả của dung dịch đệm có thể bị ảnh hưởng bởi một số yếu tố.

Các yếu tố ảnh hưởng đến dung dịch đệm
1. Tỷ lệ mol giữa axit yếu và bazơ liên hợp
-
Cân bằng hóa học: Tỷ lệ mol giữa axit yếu và bazơ liên hợp quyết định vị trí cân bằng của phản ứng phân ly axit.
-
Khả năng đệm: Khi tỷ lệ mol của hai thành phần này bằng nhau, dung dịch đệm có khả năng đệm tốt nhất.
Phương trình Henderson-Hasselbalch: Phương trình này mô tả mối quan hệ giữa pH, pKa của axit yếu và tỷ lệ mol của hai thành phần:
pH = pKa + log([A⁻]/[HA])
-
Trong đó:
-
pH: độ pH của dung dịch
-
pKa: hằng số phân ly axit
-
[A⁻]: nồng độ mol của bazơ liên hợp
-
[HA]: nồng độ mol của axit yếu
2. Nồng độ tổng cộng của cặp đệm
-
Khả năng đệm: Nồng độ tổng cộng của cặp đệm càng cao, dung dịch đệm càng có khả năng hấp thụ thêm ion H⁺ hoặc OH⁻ mà không làm thay đổi đáng kể pH.
-
Dung tích đệm: Khả năng hấp thụ ion H⁺ hoặc OH⁻ của dung dịch đệm được gọi là dung tích đệm. Dung tích đệm tỉ lệ thuận với nồng độ tổng cộng của cặp đệm.
3. Giá trị pKa của axit yếu
-
Khoảng pH đệm hiệu quả: Giá trị pKa của axit yếu xác định khoảng pH mà dung dịch đệm hoạt động hiệu quả nhất.
-
Lựa chọn dung dịch đệm: Khi chọn dung dịch đệm, cần chọn axit yếu có pKa gần với pH mong muốn.
4. Nhiệt độ
-
Ảnh hưởng đến pKa: Nhiệt độ ảnh hưởng đến hằng số phân ly axit (pKa), do đó ảnh hưởng đến khả năng đệm của dung dịch.
-
Độ tan của chất tan: Nhiệt độ có thể ảnh hưởng đến độ tan của các chất tan trong dung dịch, từ đó ảnh hưởng đến nồng độ của các thành phần đệm.
5. Lực ion
6. Sự có mặt của các chất khác
-
Các ion kim loại: Các ion kim loại có thể tạo phức với các thành phần của dung dịch đệm, làm giảm khả năng đệm.
-
Các chất hữu cơ: Các chất hữu cơ có thể tương tác với các thành phần của dung dịch đệm, ảnh hưởng đến cân bằng hóa học.
Ứng dụng của dung dịch đệm trong đời sống và công nghiệp
Dung dịch đệm, với khả năng duy trì độ pH ổn định, có vai trò vô cùng quan trọng trong nhiều lĩnh vực của cuộc sống và sản xuất. Dưới đây là một số ứng dụng điển hình:
Ứng dụng của dung dịch đệm trong đời sống và công nghiệp
Trong sinh học và y tế
-
Cơ thể người:
-
Hệ đệm bicarbonate: Duy trì pH máu ổn định, đảm bảo các quá trình trao đổi chất diễn ra bình thường.
-
Các dịch cơ thể khác: Nước bọt, dịch tiêu hóa... cũng có các hệ đệm để duy trì pH phù hợp.
-
Nuôi cấy tế bào và mô: Dung dịch đệm giúp tạo môi trường nuôi cấy có độ pH ổn định, hỗ trợ sự phát triển của tế bào.
-
Sản xuất dược phẩm: Dung dịch đệm được sử dụng để điều chỉnh pH của thuốc, đảm bảo hiệu quả điều trị và ổn định của thuốc.
Trong công nghiệp
-
Lên men: Dung dịch đệm giúp duy trì pH tối ưu cho các vi sinh vật lên men, đảm bảo hiệu suất và chất lượng sản phẩm.
-
Mạ điện: Dung dịch đệm ổn định pH của dung dịch mạ, giúp tạo ra lớp mạ chất lượng cao.
-
Sản xuất giấy: Dung dịch đệm được sử dụng để điều chỉnh độ pH trong quá trình sản xuất giấy, ảnh hưởng đến màu sắc và độ bền của giấy.
-
Xử lý nước: Dung dịch đệm được sử dụng để điều chỉnh pH của nước thải, giúp loại bỏ các chất độc hại và bảo vệ môi trường.
-
Công nghiệp thực phẩm: Dung dịch đệm được sử dụng để điều chỉnh độ pH của các sản phẩm như sữa chua, phomat, bia... giúp đảm bảo hương vị và chất lượng sản phẩm.
-
Mỹ phẩm: Dung dịch đệm được sử dụng trong các sản phẩm chăm sóc da, tóc để duy trì độ pH phù hợp với da, giúp bảo vệ da và tóc.
Trong phòng thí nghiệm
-
Phân tích hóa học: Dung dịch đệm được sử dụng để chuẩn độ pH, điều chỉnh pH của mẫu trước khi phân tích.
-
Sinh hóa: Dung dịch đệm được sử dụng để tạo môi trường pH ổn định cho các phản ứng sinh hóa, nuôi cấy tế bào.
Các ví dụ cụ thể về dung dịch đệm và ứng dụng
-
Dung dịch đệm phosphate: Được sử dụng rộng rãi trong sinh học và hóa sinh vì khả năng duy trì pH trong khoảng sinh lý.
-
Dung dịch đệm acetate: Được sử dụng trong nhiều ứng dụng phân tích hóa học.
-
Dung dịch đệm Tris: Được sử dụng trong các nghiên cứu sinh học phân tử.
-
Dung dịch đệm HEPES: Được sử dụng trong nuôi cấy tế bào và sinh hóa.
-
Dung dịch đệm bicarbonate: Là hệ đệm chính trong máu người.
Các hệ đệm phổ biến trong sinh vật
Hệ đệm là một hệ thống hóa học có khả năng duy trì độ pH ổn định trong một dung dịch khi có sự thay đổi nồng độ axit hoặc bazơ. Trong sinh vật, các hệ đệm đóng vai trò vô cùng quan trọng trong việc duy trì môi trường nội bào và ngoại bào ổn định, đảm bảo cho các quá trình sinh hóa diễn ra bình thường.
1. Hệ đệm bicarbonate:
-
Thành phần: Axit cacbonic (H₂CO₃) và ion bicarbonate (HCO₃⁻).
-
Cơ chế hoạt động: Khi pH máu tăng (kiềm hóa), axit cacbonic sẽ phân ly để giải phóng ion H⁺, làm giảm pH. Ngược lại, khi pH máu giảm (toan hóa), ion bicarbonate sẽ kết hợp với H⁺ để tạo thành axit cacbonic, làm tăng pH.
-
Vai trò: Đây là hệ đệm quan trọng nhất trong máu, giúp duy trì pH máu trong khoảng 7.35-7.45.
2. Hệ đệm phosphate:
-
Thành phần: Dihydrogen phosphate (H₂PO₄⁻) và hydrogen phosphate (HPO₄²⁻).
-
Cơ chế hoạt động: Tương tự như hệ đệm bicarbonate, hệ đệm phosphate hoạt động dựa trên sự cân bằng giữa các dạng ion H₂PO₄⁻ và HPO₄²⁻.
-
Vai trò: Hệ đệm phosphate có vai trò quan trọng trong duy trì pH trong dịch nội bào và ống thận.
3. Hệ đệm protein:
-
Thành phần: Các amino acid trong cấu trúc protein.
-
Cơ chế hoạt động: Các nhóm carboxyl (-COOH) và amino (-NH₂) trong protein có tính chất lưỡng tính, có thể đóng vai trò như axit hoặc bazơ, giúp trung hòa H⁺ hoặc OH⁻.
-
Vai trò: Hệ đệm protein đóng góp một phần đáng kể vào khả năng đệm của máu và các dịch cơ thể khác.
4. Hệ đệm hemoglobin:
-
Thành phần: Hemoglobin trong hồng cầu.
-
Cơ chế hoạt động: Hemoglobin có khả năng kết hợp với O₂ và H⁺. Khi máu đi qua các mô, hemoglobin giải phóng O₂ và kết hợp với H⁺, giúp giảm nồng độ H⁺ trong máu.
-
Vai trò: Hệ đệm hemoglobin đóng vai trò quan trọng trong vận chuyển khí và duy trì pH máu.
So sánh giữa các loại dung dịch đệm
Các loại dung dịch đệm khác nhau có những đặc điểm và ứng dụng riêng biệt. Dưới đây là bảng so sánh chi tiết giúp bạn dễ dàng hình dung:
|
Tên dung dịch đệm
|
Thành phần chính
|
Khoảng pH hiệu quả
|
Ứng dụng điển hình
|
|
Phosphate
|
Dihydrogen phosphate (H₂PO₄⁻), hydrogen phosphate (HPO₄²⁻)
|
6-8
|
Sinh học, hóa sinh, nuôi cấy tế bào
|
|
Acetate
|
Axit acetic (CH₃COOH), natri acetat (CH₃COONa)
|
3.7-5.6
|
Phân tích hóa học, chuẩn độ pH
|
|
Tris
|
Tris(hydroxymethyl)aminomethane
|
7.5-9.0
|
Sinh học phân tử, điện di
|
|
HEPES
|
4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid
|
6.8-8.2
|
Nuôi cấy tế bào, sinh hóa
|
|
MOPS
|
3-(N-morpholino)propanesulfonic acid
|
6.5-7.9
|
Sinh hóa, điện di
|
|
TES
|
N-tris(hydroxymethyl)methyl-2-aminoethanesulfonic acid
|
6.8-8.2
|
Sinh hóa
|
|
Bicarbonate
|
Axit cacbonic (H₂CO₃), ion bicarbonate (HCO₃⁻)
|
7.2-7.4
|
Hệ đệm chính trong máu
|
Nhìn nhận từ bảng trên, có thể thấy rằng mỗi loại dung dịch đệm được thiết kế với một mục đích cụ thể, tất cả đều phục vụ cho mục tiêu giữ ổn định pH trong các quá trình khác nhau.
Các yếu tố cần cân nhắc khi lựa chọn dung dịch đệm
-
Khoảng pH mong muốn: Chọn dung dịch đệm có pKa gần với pH mong muốn để đạt hiệu quả đệm tốt nhất.
-
Độ tan: Dung dịch đệm cần có độ tan tốt trong dung môi sử dụng.
-
Ổn định: Dung dịch đệm nên ổn định trong điều kiện nhiệt độ và pH khác nhau.
-
Tính tương thích: Dung dịch đệm không được tương tác với các thành phần khác trong hệ thống.
-
Ứng dụng: Mỗi loại dung dịch đệm có những ưu điểm và hạn chế riêng, cần lựa chọn loại phù hợp với từng ứng dụng cụ thể.
Ví dụ:
-
Nuôi cấy tế bào: Thường sử dụng dung dịch đệm HEPES hoặc Tris vì chúng có khoảng pH phù hợp với nhiều loại tế bào và ổn định trong điều kiện nuôi cấy.
-
Phân tích hóa học: Dung dịch đệm acetate thường được sử dụng để chuẩn độ pH vì nó có khoảng pH tương đối hẹp và ổn định.
-
Sinh lý: Hệ đệm bicarbonate là hệ đệm chính trong máu, giúp duy trì pH máu ổn định.
Lưu ý:
-
Độ tinh khiết: Sử dụng dung dịch đệm có độ tinh khiết cao để đảm bảo kết quả chính xác trong các thí nghiệm.
-
Bảo quản: Bảo quản dung dịch đệm đúng cách để tránh bị nhiễm bẩn và giảm hiệu quả.
-
Pha chế: Tuân thủ đúng quy trình pha chế để đảm bảo nồng độ và pH của dung dịch đệm.
Qua những thông tin trên của Đông Á Chemical có thể thấy dung dịch đệm đóng vai trò cực kỳ quan trọng trong cả lý thuyết hóa học và thực tiễn sinh học. Chúng không chỉ giúp duy trì độ pH ổn định qua một loạt các tình huống mà còn hoàn thành nhiệm vụ cần thiết trong nhiều lĩnh vực khác nhau từ y học đến ngành công nghiệp. Qua các hệ thống khác nhau, dung dịch đệm cho phép các hoạt động sinh hóa diễn ra hiệu quả, điều này không chỉ là một yếu tố quan trọng trong nghiên cứu mà còn là một phần thiết yếu trong cuộc sống hàng ngày. Với vai trò đáng kể của mình, dung dịch đệm đã khẳng định được vị trí quan trọng trong tự nhiên cũng như trong công nghệ hiện đại.