Phát biểu định luật bảo toàn khối lượng
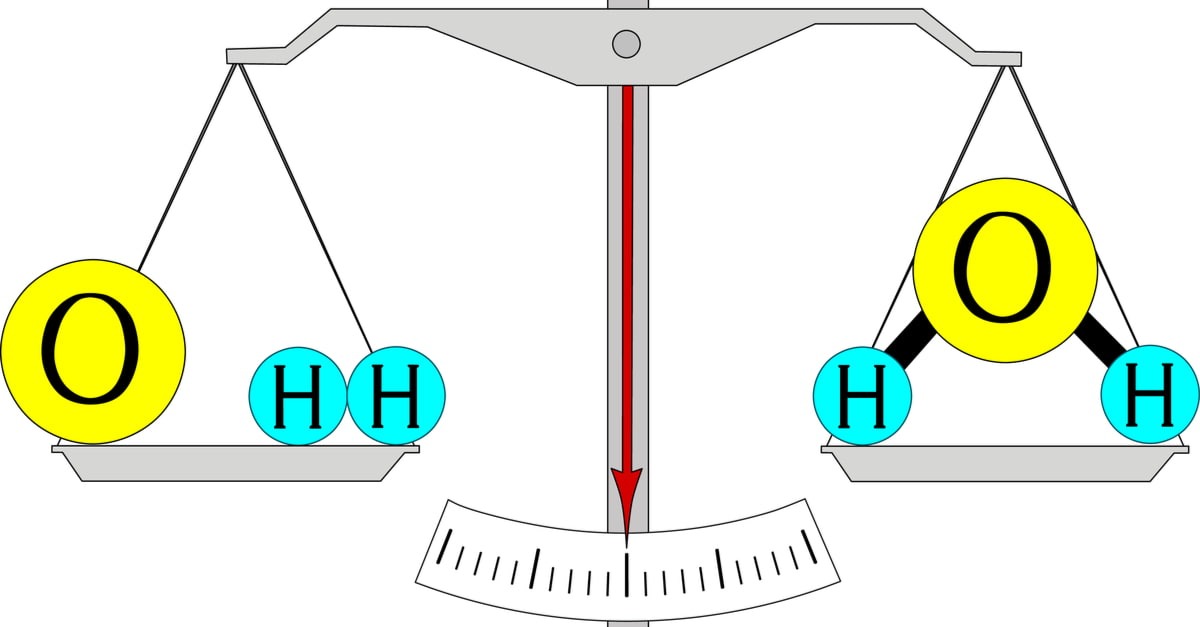
Định luật bảo toàn khối lượng được phát biểu là: "Trong một phản ứng hóa học, tổng khối lượng của các chất tham gia phản ứng bằng tổng khối lượng của các sản phẩm tạo thành". Điều này giúp chúng ta nhận thức rằng không có khối lượng nào được tạo ra hay biến mất trong một hệ thống hóa học. Để giúp hiểu sâu hơn về điều này, chúng ta có thể hình dung đến một bài toán đơn giản: nếu bạn đổ nước vào trong một chai và sau đó đóng kín chai lại, khối lượng của nước bên trong chai sẽ không thay đổi dù bạn có thực hiện những hoạt động khác nhau như lắc chai hay giữ chai đứng nghiêng. Đó chính là thực tế của định luật bảo toàn khối lượng.

Phát biểu định luật bảo toàn khối lượng
Định luật này không chỉ đơn thuần là một khái niệm lý thuyết mà thực sự có tác động lớn đến cách chúng ta làm khoa học. Các nhà hóa học dựa vào định luật này trong việc cân bằng phương trình hóa học, một bước không thể thiếu trong việc minh chứng rằng tổng khối lượng của chất trước và sau phản ứng luôn được duy trì. Điều này khẳng định một thực tế rằng, trong mỗi phản ứng liên quan đến hóa học, mặc dù có nhiều chất thay đổi trạng thái, nhưng tổng thể mọi thứ vẫn phải được giữ vững.
Ý nghĩa của định luật bảo toàn khối lượng
Ý nghĩa của định luật bảo toàn khối lượng không thể bị phớt lờ trong việc nâng cao hiểu biết khoa học của chúng ta. Nó không chỉ giúp các nhà hóa học nhận thức rõ hơn về tình hình các nguyên tố và hợp chất trong các phản ứng hóa học mà còn mang lại giá trị thực tiễn trong các lĩnh vực như sản xuất, môi trường và y học. Khả năng giữ nguyên khối lượng trong môi trường khép kín đã mở ra nhiều cơ hội cho nghiên cứu và áp dụng trong các ngành công nghiệp khác nhau. Có thể tổng hợp qua các ý chính như sau:

Ý nghĩa của định luật bảo toàn khối lượng
-
Giải thích các hiện tượng hóa học: Định luật này giúp chúng ta hiểu rõ hơn về các quá trình biến đổi hóa học xảy ra xung quanh.
-
Tính toán trong hóa học: Định luật bảo toàn khối lượng là cơ sở cho nhiều phép tính hóa học, giúp xác định khối lượng của các chất tham gia và sản phẩm trong phản ứng.
-
Bảo vệ môi trường: Định luật này nhắc nhở chúng ta về sự tuần hoàn của vật chất trong tự nhiên và tầm quan trọng của việc bảo vệ môi trường.
Ví dụ minh họa
Khi đốt cháy một mẩu than trong không khí, khối lượng của sản phẩm cháy (khí carbon dioxide) bằng tổng khối lượng của than và khí oxi đã tham gia phản ứng.
Ứng dụng của định luật trong tính toán hóa học
Định luật bảo toàn khối lượng đóng một vai trò rất quan trọng trong việc thực hiện các tính toán hóa học. Với định luật này, các nhà khoa học có thể xác định và tính toán khối lượng của từng chất trong phản ứng hóa học, từ đó giúp thực hiện các nghiên cứu một cách chính xác và hiệu quả hơn.
Tính toán khối lượng sản phẩm và chất tham gia

Ứng dụng ính toán khối lượng sản phẩm và chất tham gia
Định luật cho phép chúng ta tính được khối lượng của từng chất trong phản ứng. Nếu biết khối lượng của n-1 chất tham gia phản ứng, ta có thể dễ dàng tìm ra khối lượng của chất còn lại. Ví dụ, nếu chúng ta tiến hành một phản ứng giữa hai chất, thông qua khối lượng của sản phẩm tạo ra và các chất đã tiêu hao, chúng ta dễ dàng có được thông tin cần thiết liên quan đến khối lượng còn lại.
Cân bằng hóa học
Định luật bảo toàn khối lượng là cơ sở cho việc cân bằng phương trình hóa học. Cân bằng phương trình không chỉ giúp đảm bảo rằng tổng khối lượng của các chất phản ứng bằng tổng khối lượng của sản phẩm mà còn giúp phản ánh chính xác mối quan hệ giữa các chất trong phản ứng. Hãy tưởng tượng, nếu bạn đang nấu một công thức và cần đúng tỷ lệ các nguyên liệu, việc cân bằng tương ứng giữa chúng sẽ đảm bảo hương vị không bị mất đi.
Phân tích hỗn hợp chất
Định luật cũng hữu ích trong việc phân tích hỗn hợp, giúp xác định tỷ lệ và khối lượng của các thành phần trong hỗn hợp một cách chính xác hơn. Điều này cực kỳ quan trọng trong lĩnh vực hóa học phân tích và sản xuất công nghiệp, nơi mà sự chính xác về khối lượng có thể ảnh hưởng lớn đến chất lượng sản phẩm.
Dự đoán kết quả của phản ứng
Bằng cách áp dụng định luật, chúng ta có thể dự đoán kết quả của các phản ứng hóa học, xác định phản ứng xảy ra có hiệu quả hay không, cũng như tính toán được khối lượng cần thiết cho các phản ứng trong quy trình sản xuất quy mô lớn.
Những ứng dụng này không chỉ khẳng định tính khả thi của định luật bảo toàn khối lượng mà còn chứng tỏ sự quan trọng của nó trong nghiên cứu và thực tiễn hóa học cũng như các lĩnh vực khoa học khác.
Phương trình hóa học liên quan đến định luật bảo toàn khối lượng
Phương trình hóa học là một phần không thể thiếu trong việc chứng minh định luật bảo toàn khối lượng. Chúng thể hiện sự tương tác của các chất tham gia và sản phẩm tạo thành qua các phản ứng hóa học. Dưới đây là một số phương trình hóa học tiêu biểu có liên quan đến định luật này:
Phản ứng giữa khí metan và oxy
CH₄ + 2O₂ → CO₂ + 2H₂O
Tổng khối lượng của khí metan và oxy bằng tổng khối lượng của khí carbon dioxit và nước sau phản ứng.
Phản ứng giữa axit clohidric và natri hidroxide
HCl + NaOH → NaCl + H₂O
Tổng khối lượng của các chất phản ứng (NaOH và HCl) sẽ hoàn toàn bằng tổng khối lượng của các sản phẩm (NaCl và nước).
Phản ứng giữa canxi carbonat và axit clohidric
CaCO₃ + 2HCl → CaCl₂ + CO₂↑ + H₂O
Tổng khối lượng trước phản ứng luôn bằng tổng khối lượng sau phản ứng, trong đó có sự thải ra của khí C02.
Phản ứng giữa thủy ngân và clo
Hg + Cl₂ → HgCl₂
Trong phản ứng này, khối lượng của thủy ngân và clo phản ứng vẫn sẽ bằng khối lượng của thủy ngân clorua tạo thành.
Bằng cách cân bằng các phương trình hóa học, chúng ta thấy rõ rằng tổng khối lượng của tất cả các chất tham gia sẽ luôn bằng tổng khối lượng của các sản phẩm. Điều này không chỉ củng cố hiểu biết về phản ứng mà còn minh chứng cho sự chính xác của định luật bảo toàn khối lượng trong hóa học.
Sự khác biệt giữa định luật bảo toàn khối lượng và định luật bảo toàn năng lượng
Định luật bảo toàn khối lượng và định luật bảo toàn năng lượng đều là hai nguyên lý cơ bản trong khoa học tự nhiên, tuy nhiên, chúng có nội dung và ứng dụng khác nhau.
Sự khác biệt giữa định luật bảo toàn khối lượng và định luật bảo toàn năng lượng
-
Định luật bảo toàn khối lượng:
-
Định luật này khẳng định rằng trong một hệ thống khép kín, tổng khối lượng của các chất trước và sau phản ứng luôn không thay đổi. Mặc dù có thể xảy ra các quá trình biến đổi hóa học, nhưng không có khối lượng nào bị mất đi hoặc sản sinh thêm ra trong hệ thống.
-
Định luật bảo toàn năng lượng:
-
Ngược lại, định luật bảo toàn năng lượng tuyên bố rằng năng lượng trong một hệ kín không thể tự tạo ra hoặc tiêu biến. Tất cả năng lượng chỉ có thể chuyển đổi từ dạng này sang dạng khác. Ví dụ, năng lượng hóa học có thể được giải phóng thành năng lượng nhiệt trong các phản ứng tỏa nhiệt.
Tóm tắt sự khác biệt:
|
Khía cạnh
|
Định luật bảo toàn khối lượng
|
Định luật bảo toàn năng lượng
|
|
Nội dung
|
Khối lượng các chất không thay đổi trong phản ứng
|
Năng lượng không thể được tạo ra hoặc tiêu biến
|
|
Ứng dụng
|
Thường được sử dụng trong hóa học
|
Áp dụng rộng rãi trong vật lý và các lĩnh vực kỹ thuật khác
|
|
Ví dụ
|
Tổng khối lượng chất tham gia phản ứng bằng tổng khối lượng sản phẩm
|
Năng lượng hóa học chuyển đổi thành năng lượng nhiệt
|
Những hiện tượng thực tế chứng minh định luật bảo toàn khối lượng
Có nhiều hiện tượng thực tế mà chúng ta có thể quan sát để chứng minh cho định luật bảo toàn khối lượng. Dưới đây là những ví dụ tiêu biểu:
-
Phản ứng cháy: Khi đốt cháy một chất như giấy hoặc gỗ, khối lượng tổng cộng của các chất trước phản ứng (giấy, không khí) và sau phản ứng (carbon dioxit và hơi nước) sẽ không thay đổi. Sự chuyển đổi này thể hiện rằng khối lượng được bảo toàn dù hình dạng có thể thay đổi.
-
Phản ứng nung đá vôi: Khi nung đá vôi (cacbonat canxi), các sản phẩm thu được bao gồm canxi oxit (CaO) và khí cacbon dioxit (CO2). Tổng khối lượng đá vôi trước khi nung và tổng khối lượng canxi oxit, khí cacbon dioxit thu được sẽ tương đương, minh chứng cho định luật bảo toàn khối lượng.
-
Quá trình trộn: Khi trộn 200g đường và nước, tổng khối lượng của hỗn hợp vẫn sẽ là 200g. Dù đường hòa vào nước tạo thành dung dịch, nhưng tổng khối lượng trước và sau hành động này không có sự thay đổi.
-
Phản ứng giữa axit và bazo: Trong phản ứng giữa axit clohidric và natri hydroxide, tổng khối lượng của các thành phần trước khi phản ứng sẽ bằng tổng khối lượng của natri clorua và nước thu được.
Các hiện tượng trên không chỉ chứng minh cho định luật bảo toàn khối lượng mà còn nhấn mạnh vai trò của chúng trong việc hiểu rõ các quy luật tự nhiên và ứng dụng chúng trong thực tiễn.
Các sai lầm thường gặp khi áp dụng định luật bảo toàn khối lượng
Trong quá trình học tập và thực hành hóa học, có thể có một số sai lầm thường gặp liên quan đến định luật bảo toàn khối lượng. Đây là một số vấn đề cụ thể:
Hiểu sai về khối lượng
Nhiều người chưa nhận thức được rằng không chỉ các chất rắn mà cả khí đều có khối lượng. Lỗi này cảm thấy đặc biệt trong các phản ứng có khí tham gia, nơi khối lượng của các chất khí thường dễ dàng bị lãng quên.
Không tính đến sản phẩm khí
Một số phản ứng tạo ra khí và nếu không ghi nhận khối lượng của chất khí, người thực hiện sẽ có thể nghĩ rằng khối lượng bị mất đi. Điều này dẫn đến việc áp dụng sai định luật bảo toàn khối lượng.
Thí nghiệm trong điều kiện không kín
Việc không thực hiện thí nghiệm trong hệ kín sẽ làm cho khối lượng sản phẩm có thể thiếu hụt do các yếu tố môi trường như hơi nước hay khí gas bay hơi.
Không chú ý đến nước trong phản ứng
Một số phản ứng diễn ra trong môi trường dung dịch và người thực nghiệm thường không chú ý đến khối lượng của dung môi. Điều này có thể dẫn đến sai sót trong tính toán.
Sai sót trong cách đo lường
Sai số khi đo khối lượng là một trong những nguyên nhân chủ yếu dẫn đến những nhầm lẫn trong việc áp dụng định luật bảo toàn khối lượng. Nếu sử dụng dụng cụ không chính xác, kết quả thu được có thể không đúng thực tế.
Việc nhận biết những sai lầm này giúp mọi người hiểu rõ về định luật bảo toàn khối lượng, từ đó áp dụng đúng trong thí nghiệm và các công việc liên quan đến hóa học.
Tóm lại, định luật bảo toàn khối lượng không chỉ đơn thuần là một nguyên lý lý thuyết mà nó còn là một công cụ thiết yếu giúp chúng ta hiểu rõ hơn về các quy luật hành vi của vật chất trong hóa học. Qua bài viết này của Đông Á, hy vọng các bạn sẽ biết cách vận dụng đúng cách định luật này cho những ứng dụng cụ thể trong đời sống.