Điều kiện phản ứng hóa học đóng vai trò vô cùng quan trọng trong việc xác định sự xảy ra và hiệu suất của các phản ứng hóa học. Nếu không có những yếu tố cần thiết này, các phản ứng hóa học có thể không thể diễn ra, hoặc diễn ra chậm chạp, không hiệu quả. Để có một cái nhìn tổng quan, trong bài viết này, dongachem.vn sẽ giúp các bạn tìm hiểu các yếu tố ảnh hưởng cũng như vai trò của điều kiện phản ứng và ứng dụng của chúng trong cuộc sống hàng ngày, từ nghiên cứu khoa học đến sản xuất công nghiệp.
Điều kiện phản ứng là gì?
Điều kiện phản ứng là tập hợp các yếu tố bên ngoài tác động lên quá trình diễn ra của một phản ứng hóa học. Những yếu tố này có thể làm tăng tốc độ, giảm tốc độ hoặc thậm chí ngăn chặn phản ứng xảy ra.
Tưởng tượng điều kiện phản ứng như một "bếp lửa" của phản ứng hóa học. Mỗi phản ứng cần một "lửa" ở một mức nhiệt độ, áp suất và các yếu tố khác nhau để cháy. Nếu "lửa" quá nhỏ, phản ứng sẽ diễn ra chậm hoặc không xảy ra. Ngược lại, nếu "lửa" quá lớn, phản ứng có thể xảy ra quá nhanh và gây nguy hiểm.
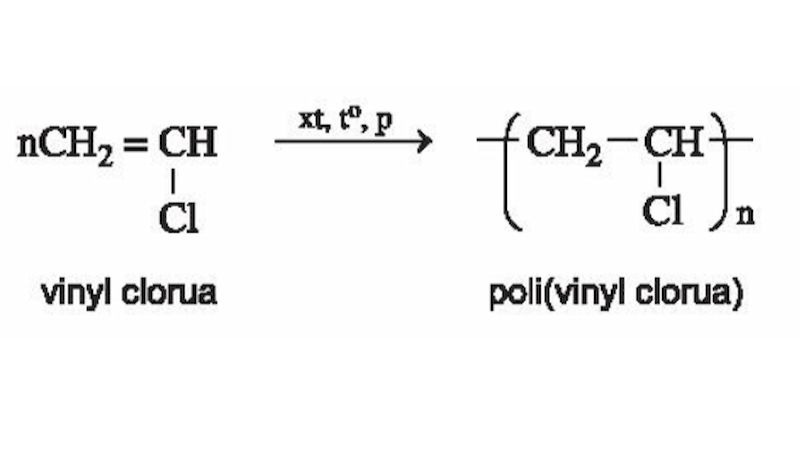
Phản ứng này xảy ra khi có điều kiện gồm nhiệt độ, áp suất và chất xúc tác
Các yếu tố ảnh hưởng đến điều kiện phản ứng
Các yếu tố chính ảnh hưởng đến điều kiện phản ứng bao gồm:
-
Nhiệt độ:
-
Tăng nhiệt độ: Thông thường, tăng nhiệt độ sẽ làm tăng tốc độ phản ứng. Vì nhiệt độ cao cung cấp năng lượng cho các phân tử, giúp chúng va chạm mạnh hơn và thường xuyên hơn, từ đó tăng khả năng hình thành các liên kết mới.
-
Giảm nhiệt độ: Ngược lại, giảm nhiệt độ sẽ làm giảm tốc độ phản ứng.
-
Áp suất:
-
Áp suất chủ yếu ảnh hưởng đến các phản ứng có chất khí tham gia. Tăng áp suất sẽ làm tăng nồng độ của các chất khí, từ đó tăng số lần va chạm giữa các phân tử và tăng tốc độ phản ứng.
-
Lưu ý: Ảnh hưởng của áp suất đến tốc độ phản ứng phụ thuộc vào số mol khí ở hai vế của phương trình hóa học.
-
Nồng độ:
-
Chất xúc tác:
-
Diện tích tiếp xúc:
-
Dung môi:
Ví dụ về ảnh hưởng của điều kiện phản ứng
-
Đốt cháy nhiên liệu: Để đốt cháy một khúc gỗ, ta cần cung cấp đủ nhiệt độ (đánh lửa) và oxi (quạt gió).
-
Sắt bị gỉ: Sắt bị gỉ nhanh hơn trong môi trường ẩm ướt và có nhiều khí CO₂. Đây là do nước và CO₂ tạo điều kiện cho phản ứng oxi hóa sắt.
-
Sản xuất amoniac: Quá trình sản xuất amoniac từ nitơ và hydro sử dụng chất xúc tác sắt và điều kiện nhiệt độ và áp suất cao.
Lưu ý: Các yếu tố trên thường tác động tương hỗ lên nhau. Ví dụ, tăng nhiệt độ đồng thời với tăng áp suất sẽ làm tăng tốc độ phản ứng một cách đáng kể.
Các loại điều kiện phản ứng trong hóa học
Khi nghiên cứu về điều kiện phản ứng, chúng ta không thể bỏ qua việc phân loại chúng theo từng loại phản ứng hóa học khác nhau. Mỗi loại đều có những đặc điểm riêng, thể hiện cách mà các yếu tố ảnh hưởng đến chúng.

Mỗi phản ứng hóa học khác nhau sẽ có điều kiện phản ứng khác nhau
-
Điều kiện phản ứng trong phản ứng nhiệt động: Đây được xem là một trong những loại phản ứng quan trọng trong hóa học, liên quan đến năng lượng và nhiệt độ. Phản ứng nhiệt động thường xảy ra tại nhiệt độ cao và có thể thu hút hoặc giải phóng năng lượng.
-
Điều kiện phản ứng trong các phản ứng xúc tác: Chất xúc tác đóng vai trò then chốt, giúp tăng tốc độ phản ứng mà không tham gia vào phản ứng hóa học. Các phản ứng này thường diễn ra ở điều kiện nhẹ nhàng hơn và có thể tiết kiệm năng lượng.
-
Điều kiện phản ứng trong phản ứng oxi hóa-khử: Các phản ứng này phụ thuộc vào mật độ electron và thường yêu cầu điều kiện nhiệt độ và áp suất nhất định để phân hủy các chất phản ứng, giúp chúng tạo ra sản phẩm mong muốn.
-
Điều kiện phản ứng trong phản ứng hóa học đồng thể và dị thể: Đối với phản ứng đồng thể (tất cả các chất tham gia ở cùng một giai đoạn), điều kiện như nhiệt độ chủ yếu chi phối, trong khi ở phản ứng dị thể, diện tích tiếp xúc giữa các giai đoạn khác nhau trở nên quan trọng hơn.
Vai trò của điều kiện phản ứng trong các phản ứng hóa học
Điều kiện phản ứng đóng vai trò quyết định trong việc xác định không chỉ khả năng phản ứng mà còn là tỷ lệ và hiệu suất của chúng. Từng yếu tố như nhiệt độ, áp suất, nồng độ và chất xúc tác đều góp phần hình thành nên những sản phẩm cuối cùng với chất lượng khác nhau.
-
Tăng cường khả năng phản ứng: Điều kiện phù hợp giúp các phân tử có sức mạnh hơn, tăng khả năng va chạm giữa chúng, từ đó tạo ra số lượng sản phẩm lớn hơn trong thời gian ngắn hơn. Hằng số tỷ lệ phản ứng có thể được điều chỉnh bằng cách thay đổi các yếu tố này.
-
Quyết định sản phẩm cuối cùng: Không chỉ là việc phản ứng diễn ra nhanh hay chậm, điều kiện phản ứng còn quyết định loại sản phẩm cuối cùng. Ví dụ, trong phản ứng giữa betaine và phenol có thể tạo ra nhiều sản phẩm khác nhau dựa vào các yếu tố như nhiệt độ và pH.
-
Tính ổn định và an toàn: Điều kiện phản ứng không chỉ ảnh hưởng đến sản phẩm mà còn có vai trò quan trọng trong việc đảm bảo an toàn cho phản ứng. Những phản ứng diễn ra ở nhiệt độ thấp có thể dễ kiểm soát hơn, làm giảm nguy cơ phản ứng không mong muốn.
-
Khả năng tái sử dụng: Với sự có mặt của chất xúc tác, nhiều phản ứng có thể tái hiện nhiều lần mà không cần thay đổi các điều kiện. Điều này cho phép tiết kiệm tài nguyên và làm giảm lượng chất thải sinh ra trong quá trình sản xuất.
So sánh điều kiện phản ứng trong các loại phản ứng khác nhau
Điều kiện phản ứng là tập hợp các yếu tố bên ngoài tác động lên quá trình diễn ra của một phản ứng hóa học. Mỗi loại phản ứng hóa học thường có những điều kiện phản ứng đặc trưng. Tuy nhiên, một số yếu tố như nhiệt độ, áp suất, nồng độ, chất xúc tác lại là những yếu tố chung ảnh hưởng đến hầu hết các phản ứng. So sánh điều kiện phản ứng trong một số loại phản ứng phổ biến trong bảng dưới đây:
|
Loại phản ứng
|
Điều kiện phản ứng đặc trưng
|
Ví dụ
|
|
Phản ứng trung hòa
|
Thường xảy ra ở điều kiện thường, trong dung dịch nước.
|
Axit + Bazơ → Muối + Nước
|
|
Phản ứng trao đổi
|
Nhiều loại phản ứng trao đổi xảy ra ở điều kiện thường. Một số phản ứng cần đun nóng để tăng tốc độ.
|
Muối + Muối → 2 Muối mới
|
|
Phản ứng oxi hóa - khử
|
Đa dạng điều kiện. Nhiều phản ứng cần cung cấp nhiệt hoặc điện năng. Một số phản ứng cần chất xúc tác.
|
Sắt + Oxi → Sắt (III) oxit
|
|
Phản ứng phân hủy
|
Nhiều phản ứng phân hủy cần cung cấp nhiệt hoặc điện năng.
|
CaCO₃ → CaO + CO₂
|
|
Phản ứng hóa hợp
|
Một số phản ứng hóa hợp xảy ra ở điều kiện thường, một số cần đun nóng hoặc chiếu sáng.
|
2H₂ + O₂ → 2H₂O
|
|
Phản ứng thế
|
Đa dạng điều kiện. Nhiều phản ứng thế xảy ra ở điều kiện thường, một số cần đun nóng hoặc chiếu sáng.
|
Zn + H₂SO₄ → ZnSO₄ + H₂
|
Lưu ý: Bảng trên chỉ là một số ví dụ và không bao gồm tất cả các loại phản ứng hóa học. Điều kiện phản ứng có thể thay đổi tùy thuộc vào từng phản ứng cụ thể và các yếu tố khác như bản chất của chất tham gia, nồng độ, dung môi...
Các phương pháp xác định điều kiện phản ứng
Việc xác định điều kiện phản ứng tối ưu là một trong những yếu tố quan trọng trong nghiên cứu và ứng dụng hóa học. Dưới đây là một số phương pháp thường được sử dụng để xác định điều kiện phản ứng:

Các phương pháp xác định điều kiện phản ứng
1. Phương pháp thực nghiệm:
2. Phương pháp lý thuyết:
-
Sử dụng các nguyên lý nhiệt động học: Dựa vào các thông số nhiệt động học như enthalpy, entropy, năng lượng Gibbs để dự đoán khả năng xảy ra và hướng đi của phản ứng.
-
Sử dụng các mô hình động học: Mô phỏng quá trình phản ứng trên máy tính để dự đoán tốc độ phản ứng và xác định các điều kiện tối ưu.
-
Sử dụng các phần mềm chuyên dụng: Các phần mềm như COMSOL Multiphysics, MATLAB, ANSYS có thể được sử dụng để mô phỏng và phân tích các quá trình phản ứng phức tạp.
3. Phương pháp kết hợp:
Thường thì việc xác định điều kiện phản ứng tối ưu kết hợp cả phương pháp thực nghiệm và lý thuyết. Bằng cách sử dụng các mô hình lý thuyết để dự đoán các điều kiện ban đầu, sau đó tiến hành các thí nghiệm để kiểm chứng và điều chỉnh mô hình, ta có thể đạt được kết quả chính xác hơn.
Các yếu tố cần xem xét khi xác định điều kiện phản ứng:
-
Mục tiêu của phản ứng: Tối đa hóa tốc độ phản ứng, hiệu suất, độ tinh khiết của sản phẩm, hoặc giảm thiểu chi phí.
-
Bản chất của phản ứng: Mỗi loại phản ứng có những đặc điểm riêng, đòi hỏi các điều kiện phản ứng khác nhau.
-
Các hạn chế về thiết bị và nguyên liệu: Khả năng của thiết bị và chi phí của nguyên liệu cũng ảnh hưởng đến việc lựa chọn điều kiện phản ứng.
-
Các yếu tố môi trường: Nhiệt độ phòng, độ ẩm, ánh sáng... cũng có thể ảnh hưởng đến phản ứng.
Ví dụ:
-
Sản xuất amoniac: Quá trình sản xuất amoniac sử dụng điều kiện nhiệt độ và áp suất cao, cùng với chất xúc tác sắt để tăng hiệu suất phản ứng.
-
Sản xuất axit sulfuric: Quá trình sản xuất axit sulfuric sử dụng nhiều giai đoạn phản ứng khác nhau, mỗi giai đoạn có điều kiện nhiệt độ, áp suất và chất xúc tác khác nhau.
Ứng dụng của điều kiện phản ứng trong công nghiệp
Việc hiểu và kiểm soát các điều kiện phản ứng đóng vai trò cực kỳ quan trọng trong nhiều ngành công nghiệp. Bằng cách điều chỉnh các yếu tố như nhiệt độ, áp suất, nồng độ, chất xúc tác, người ta có thể tối ưu hóa quá trình sản xuất, nâng cao hiệu suất và giảm thiểu chi phí.

Ứng dụng của điều kiện phản ứng trong công nghiệp
Dưới đây là một số ví dụ cụ thể về ứng dụng của điều kiện phản ứng trong công nghiệp:
1. Ngành công nghiệp hóa chất:
-
Tổng hợp amoniac: Quá trình Haber-Bosch tổng hợp amoniac từ nitơ và hydro được thực hiện ở nhiệt độ cao, áp suất cao và có sự hiện diện của chất xúc tác sắt. Điều kiện này giúp tăng tốc độ phản ứng và chuyển dịch cân bằng về phía sản phẩm.
-
Sản xuất axit sulfuric: Quá trình sản xuất axit sulfuric bao gồm nhiều giai đoạn, mỗi giai đoạn có điều kiện nhiệt độ, áp suất và chất xúc tác khác nhau.
-
Sản xuất nhựa: Điều kiện phản ứng như nhiệt độ, áp suất và loại xúc tác quyết định loại nhựa và tính chất của nó.
2. Ngành công nghiệp luyện kim:
-
Sản xuất thép: Quá trình luyện thép liên quan đến việc điều chỉnh nhiệt độ, thành phần hóa học của quặng và các chất phụ gia để đạt được các loại thép có tính chất khác nhau.
-
Luyện nhôm: Điện phân nhôm oxit nóng chảy trong điều kiện nhiệt độ cao và dòng điện một chiều để sản xuất nhôm kim loại.
3. Ngành công nghiệp thực phẩm:
-
Chế biến thực phẩm: Nhiệt độ, thời gian gia nhiệt, độ pH ảnh hưởng đến quá trình nấu chín, lên men và bảo quản thực phẩm.
-
Sản xuất đồ uống: Quá trình lên men rượu vang, bia được thực hiện trong điều kiện nhiệt độ, độ pH và loại men khác nhau.
4. Ngành công nghiệp năng lượng:
-
Sản xuất nhiên liệu sinh học: Điều kiện phản ứng ảnh hưởng đến quá trình chuyển hóa nguyên liệu sinh khối thành nhiên liệu sinh học.
-
Sản xuất pin: Điều kiện phản ứng trong quá trình sản xuất pin quyết định dung lượng, tuổi thọ và hiệu suất của pin.
5. Các ngành công nghiệp khác:
-
Sản xuất dược phẩm: Điều kiện phản ứng được kiểm soát chặt chẽ để đảm bảo chất lượng và độ tinh khiết của các hợp chất dược phẩm.
-
Xử lý nước thải: Các quá trình xử lý nước thải thường liên quan đến việc điều chỉnh pH, nhiệt độ và các yếu tố khác để loại bỏ các chất ô nhiễm.
Một số lợi ích khi kiểm soát tốt điều kiện phản ứng:
-
Tăng hiệu suất phản ứng: Giảm thiểu lượng chất thải, tiết kiệm năng lượng và nguyên liệu.
-
Cải thiện chất lượng sản phẩm: Đạt được các đặc tính mong muốn của sản phẩm như độ tinh khiết, độ bền.
-
Giảm chi phí sản xuất: Tối ưu hóa quá trình sản xuất, giảm thiểu thời gian và chi phí.
-
Bảo vệ môi trường: Giảm thiểu lượng chất thải và khí thải độc hại.
Việc hiểu rõ điều kiện phản ứng là rất quan trọng không chỉ cho các nhà khoa học mà còn cho các nhà sản xuất trong công nghiệp. Các yếu tố như nhiệt độ, nồng độ, áp suất và sự có mặt của chất xúc tác ảnh hưởng sâu sắc đến tốc độ và kết quả của các phản ứng hóa học. Từ những phản ứng đơn giản trong phòng thí nghiệm cho đến quy trình sản xuất phức tạp trong ngành công nghiệp, điều kiện phản ứng cần phải được kiểm soát chặt chẽ để đạt được kết quả mong muốn. Dongachem.vn hy vọng rằng bằng cách nắm vững các yếu tố này, chúng ta có thể tối ưu hóa quá trình sản xuất, tiết kiệm tài nguyên và nâng cao hiệu quả kinh tế.