Chất điện li là một trong những khái niệm quan trọng trong hóa học, mang đến những hiểu biết sâu sắc về tính chất và ứng dụng của các chất này trong đời sống thường nhật cũng như trong công nghiệp. Nếu bạn đã từng thắc mắc về lý do tại sao nước muối có thể dẫn điện hay làm thế nào mà cơ thể con người duy trì được trạng thái cân bằng điện giải, thì bạn đã đến đúng chỗ! Trong bài viết này, chúng ta sẽ cùng nhau khám phá chất điện li là gì, một chủ đề hấp dẫn và đầy thú vị trong thế giới hóa học.
Định nghĩa chất điện li là gì?
Chất điện li là những chất khi hòa tan trong nước phân li ra các ion (cation và anion). Các ion này mang điện tích dương hoặc âm và có khả năng di chuyển tự do trong dung dịch.
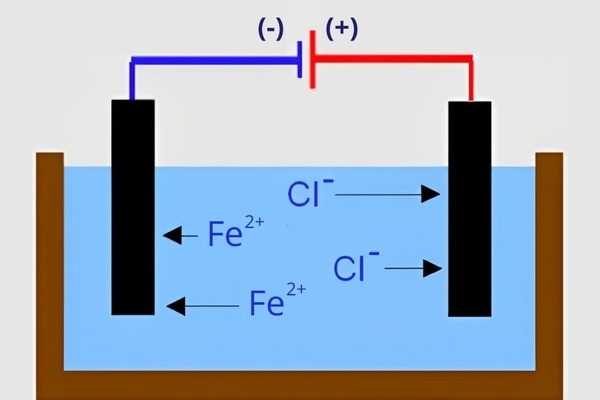
Minh họa cho chất điện li
Tính Chất của Chất Điện Li
-
Dẫn điện: Dung dịch của chất điện li dẫn điện được do sự di chuyển của các ion tự do dưới tác động của điện trường.
-
Tác dụng với nhiều chất khác: Ion của chất điện li có thể tham gia vào các phản ứng hóa học với nhiều chất khác, tạo ra các hợp chất mới.
-
Làm đổi màu chất chỉ thị: Nhiều chất điện li làm đổi màu các chất chỉ thị như phenolphtalein, quỳ tím.
Tại Sao Chất Điện Li Dẫn Điện?
Khi một chất điện li hòa tan vào nước, các phân tử của nó sẽ bị phân ly thành các ion dương và ion âm. Các ion này di chuyển tự do trong dung dịch.
Các loại chất điện li
Chất điện li có thể được phân loại thành hai loại chính: chất điện li mạnh và chất điện li yếu. Việc phân loại này giúp chúng ta hiểu rõ hơn về tính chất và tiềm năng ứng dụng của các chất này trong nhiều lĩnh vực khác nhau.
Có nhiều loại chất điện li khác nhau
1. Chất điện li mạnh
Chất điện li mạnh là những chất khi hòa tan trong nước sẽ phân li hoàn toàn thành ion. Một số ví dụ điển hình bao gồm:
|
Loại chất điện li mạnh
|
Công thức
|
|
Axit mạnh
|
HCl, H₂SO₄, HNO₃
|
|
Bazơ mạnh
|
NaOH, KOH
|
|
Muối
|
NaCl, KBr
|
Phương trình điện li của chất điện li mạnh thường được biểu diễn bằng mũi tên một chiều, cho thấy rằng chúng phân li hoàn toàn thành ion khi hòa tan.
2. Chất điện li yếu
Ngược lại với chất điện li mạnh, chất điện li yếu chỉ phân li một phần khi hòa tan trong nước. Một số ví dụ bao gồm:
-
Axit yếu: CH₃COOH, HCN
-
Bazơ yếu: NH₃, HF
|
Loại chất điện li yếu
|
Công thức
|
|
Axit yếu
|
CH₃COOH, HCN
|
|
Bazơ yếu
|
NH₃, HF
|
Phương trình điện li cho các chất điện li yếu thường sử dụng mũi tên hai chiều, phản ánh tính chất thuận nghịch của quá trình điện li, cho phép sự tái hợp giữa các ion và phân tử chưa phân li.
Quy trình điện li
Quy trình điện li diễn ra khi một chất hòa tan trong nước hoặc dung môi, tạo thành các ion dương và âm. Quá trình này có thể chia thành các giai đoạn rõ ràng:
-
Hòa tan: Chất điện li được thêm vào trong môi trường (thường là nước), làm cho phân tử chất tan bắt đầu bị tách ra.
-
Phân ly: Khi hòa tan, các liên kết trong phân tử bị phá vỡ, cho phép các ion tự do hình thành. Chẳng hạn, NaCl sẽ phân li thành Na⁺ và Cl⁻.
-
Tạo ion: ngay khi các ion được hình thành, chúng sẽ di chuyển trong dung dịch, tạo ra khả năng dẫn điện.
-
Đạt đến trạng thái cân bằng: Trong trường hợp chất điện li yếu, khi quá trình điện li diễn ra, một số ion có thể tái hợp với nhau tạo thành phân tử ban đầu, thiết lập trạng thái cân bằng.
|
Giai đoạn
|
Mô tả
|
|
Hòa tan
|
Nhập chất vào dung môi
|
|
Phân ly
|
Phân tử bị tách ra thành ion
|
|
Tạo ion
|
Ion di chuyển tự do trong dung dịch
|
|
Cân bằng
|
Thiết lập trạng thái cân bằng điện li
|
Độ điện li là gì?
Độ điện li là một đại lượng đặc trưng cho khả năng phân li thành ion của một chất điện li khi hòa tan trong nước. Nói cách khác, nó cho biết phần trăm số phân tử chất điện li đã phân li thành ion so với tổng số phân tử chất điện li ban đầu.
Ý nghĩa của Độ Điện Li
-
Đánh giá tính mạnh yếu của chất điện li: Chất điện li mạnh có độ điện li gần bằng 1, nghĩa là hầu hết các phân tử đều phân li thành ion. Ngược lại, chất điện li yếu có độ điện li nhỏ hơn 1, tức là chỉ một phần nhỏ phân tử phân li.
-
Dự đoán tính dẫn điện của dung dịch: Dung dịch của chất điện li mạnh dẫn điện tốt hơn dung dịch của chất điện li yếu vì nồng độ ion trong dung dịch càng lớn thì khả năng dẫn điện càng cao.
-
Ảnh hưởng đến tính chất hóa học của dung dịch: Độ điện li ảnh hưởng đến tốc độ phản ứng, tính pH của dung dịch và nhiều tính chất hóa học khác.
Công thức Tính Độ Điện Li
Độ điện li thường được ký hiệu là α (alpha) và tính theo công thức:
α = (số mol chất điện li phân li) / (số mol chất điện li ban đầu)
Ví dụ
Giả sử ta có 1 mol axit axetic (CH₃COOH) hòa tan trong nước và có 0,01 mol phân tử axit axetic phân li thành ion. Khi đó, độ điện li của axit axetic sẽ là:
α = 0,01 mol / 1 mol = 0,01 = 1%
Điều này cho thấy chỉ có 1% phân tử axit axetic phân li thành ion, còn lại vẫn ở dạng phân tử.
Ảnh hưởng của Các Yếu Tố Đến Độ Điện Li
-
Bản chất của chất điện li: Mỗi chất điện li có độ điện li đặc trưng.
-
Nồng độ: Nồng độ dung dịch càng loãng thì độ điện li càng lớn.
-
Nhiệt độ: Nói chung, khi tăng nhiệt độ, độ điện li tăng.
-
Chất tan cùng tồn tại: Sự có mặt của các ion khác trong dung dịch có thể làm tăng hoặc giảm độ điện li của chất điện li đó.
Vai Trò của Độ Điện Li
-
Hóa học: Độ điện li giúp giải thích nhiều hiện tượng hóa học như sự dẫn điện của dung dịch, tính chất của dung dịch axit, bazơ, muối.
-
Sinh học: Độ điện li ảnh hưởng đến quá trình trao đổi chất trong cơ thể sống.
-
Công nghiệp: Độ điện li được ứng dụng trong nhiều quá trình sản xuất, như sản xuất pin, điện phân.
Các ứng dụng của chất điện li
Chất điện li, với khả năng phân li thành ion trong dung dịch và tạo ra dòng điện, có vai trò vô cùng quan trọng trong nhiều lĩnh vực của đời sống. Dưới đây là một số ứng dụng điển hình:
1. Pin và Ắc quy:

Chất điện li được ứng dụng trong pin và ắc quy
-
Nguyên lý hoạt động: Sự chuyển đổi năng lượng hóa học thành điện năng dựa trên quá trình điện phân dung dịch chất điện li.
-
Các loại pin: Pin khô, pin kiềm, ắc quy chì-axit, pin lithium-ion...
-
Ứng dụng: Cung cấp năng lượng cho các thiết bị điện tử, xe điện, xe hybrid.
2. Điện phân:
-
Nguyên lý hoạt động: Sử dụng dòng điện một chiều để phân hủy các hợp chất thành các chất đơn giản hơn.
-
Ứng dụng: Sản xuất kim loại (nhôm, đồng), clo, xút, mạ điện, tinh luyện kim loại.
3. Ngành công nghiệp hóa chất:
-
Sản xuất axit, bazơ: Điện phân dung dịch muối để sản xuất các axit, bazơ mạnh.
-
Tổng hợp hữu cơ: Nhiều phản ứng hữu cơ sử dụng môi trường dung dịch chất điện li để tăng tốc độ phản ứng hoặc tạo điều kiện thuận lợi cho phản ứng xảy ra.
4. Y học và Sinh học:
-
Dung dịch điện giải: Bù nước và chất điện giải cho cơ thể khi bị mất nước do tiêu chảy, nôn mửa.
-
Điện tâm đồ: Đo hoạt động điện của tim dựa trên sự truyền dẫn xung điện qua các ion trong cơ thể.
-
Điện não đồ: Đo hoạt động điện của não.
5. Xử lý nước:
6. Ngành nông nghiệp:
-
Phân bón: Nhiều loại phân bón là các hợp chất ion, cung cấp các chất dinh dưỡng cần thiết cho cây trồng.
-
Điều chỉnh độ pH đất: Sử dụng các chất điện li để điều chỉnh độ pH đất phù hợp cho từng loại cây trồng.
7. Pin nhiên liệu:
-
Nguyên lý hoạt động: Chuyển đổi trực tiếp năng lượng hóa học thành điện năng thông qua phản ứng oxi hóa khử giữa hydro và oxy.
-
Ứng dụng: Nguồn năng lượng sạch cho các thiết bị di động, xe ô tô.
8. Ngành sơn:
Phân biệt chất điện li và không điện li
Việc phân biệt chất điện li và các chất không điện li là rất quan trọng trong hóa học, bởi điều này ảnh hưởng đến khả năng dẫn điện và ứng dụng của chúng. Dưới đây là sự khác biệt giữa chất điện li và chất không điện li:
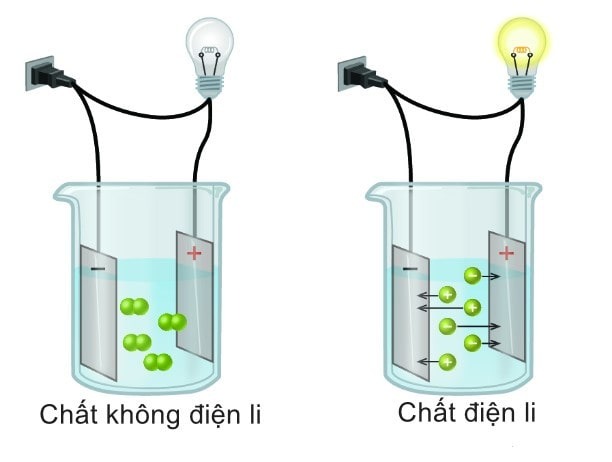
Sự khác biệt giữa chất điện li và không điện li
|
Tính chất
|
Chất điện li
|
Chất không điện li
|
|
Phân tử trong dung dịch
|
Phân li thành ion
|
Tồn tại dưới dạng phân tử
|
|
Khả năng dẫn điện
|
Dẫn điện
|
Không dẫn điện
|
|
Ví dụ
|
Muối ăn (NaCl), axit clohidric (HCl), natri hidroxit (NaOH),...
|
Đường, rượu etylic, nước cất,...
|
Lý do dẫn đến sự khác biệt
-
Cấu tạo hóa học: Chất điện li thường là hợp chất ion (như muối) hoặc hợp chất có liên kết cộng hóa trị phân cực mạnh (như axit, bazơ). Khi hòa tan trong nước, các liên kết này bị phá vỡ và các ion được giải phóng.
-
Tính chất của dung môi: Nước là một dung môi phân cực, có khả năng hòa tan các chất phân cực và ion. Khi các chất điện li hòa tan trong nước, các phân tử nước bao quanh các ion, làm giảm lực hút giữa các ion và giúp chúng tách rời nhau.
Với những thông tin dongachem.vn vừa chia sẻ trên có thể thấy chất điện li không chỉ là những khái niệm khô khan trong sách vở, mà thực sự là những yếu tố sống còn trong sự vận hành của thế giới xung quanh chúng ta. Từ việc cung cấp năng lượng cho các thiết bị điện tử cho đến việc duy trì hoạt động bình thường của cơ thể, chất điện li đóng vai trò thiết yếu trong đời sống hàng ngày. Sự khám phá về chất điện li là gì không chỉ giúp nâng cao hiểu biết về hóa học mà còn mở ra cơ hội để ứng dụng những kiến thức đó trong thực tế, đóng góp vào sự phát triển của khoa học và công nghệ.