Cấu hình electron không chỉ là một khái niệm cơ bản trong hóa học và vật lý, mà còn là chìa khóa để mở ra thế giới tuyệt diệu của nguyên tử và phân tử. Sự phân bố của electron không chỉ quyết định tính chất hóa học mà còn tác động đến tính chất vật lý của các chất. Trong bài viết này, chúng ta sẽ đi qua các khía cạnh khác nhau của cấu hình electron, từ định nghĩa, tầm quan trọng, cách viết đến ý nghĩa của các lớp electron và cấu hình electron rút gọn.
Định nghĩa cấu hình electron
Cấu hình electron là cách chúng ta mô tả cách các electron sắp xếp xung quanh hạt nhân của một nguyên tử. Hãy tưởng tượng nguyên tử như một tòa nhà cao tầng, mỗi tầng là một lớp electron và mỗi phòng là một orbital (khu vực mà electron có khả năng xuất hiện). Cấu hình e sẽ cho biết có bao nhiêu electron ở mỗi tầng và phòng. Ví dụ, cấu hình e của nguyên tử helium được viết là 1s², cho thấy rằng nguyên tử này có hai electron trong lớp 1s. Một ví dụ khác là cấu hình e của carbon (C), được biểu thị là 1s² 2s² 2p², cho biết carbon có tổng cộng 6 electron với phân bổ cụ thể trong các lớp electron.

Định nghĩa cấu hình electron
|
Nguyên tử
|
Số hiệu nguyên tử (Z)
|
Cấu hình electron
|
|
Helium
|
2
|
1s²
|
|
Carbon
|
6
|
1s² 2s² 2p²
|
|
Oxy
|
8
|
1s² 2s² 2p⁴
|
|
Neon
|
10
|
1s² 2s² 2p⁶
|
Nhìn vào bảng trên, chúng ta có thể thấy cách mà các electron được phân bố trong các lớp khác nhau và sự thay đổi trong cấu hình electron khi số hiệu nguyên tử tăng lên. Điều này gợi nhớ đến sự phát triển của một cây cổ thụ, nơi mà các nhánh rễ là các lớp electron, càng nhiều rễ thì khả năng sinh trưởng và phát triển của cây càng phong phú.
Tại sao cấu hình electron lại quan trọng?
Cấu hình electron đóng một vai trò vô cùng quan trọng trong hóa học và vật lý nguyên tử. Nó không chỉ đơn thuần là cách phân bổ electron, mà còn quyết định nhiều tính chất phản ứng của nguyên tử. Một trong những lý do chính mà cấu hình e quan trọng chính là nó quyết định tính chất hóa học của nguyên tố. Các electron ở lớp ngoài cùng (electron hóa trị) là yếu tố chủ yếu trong việc hình thành liên kết hóa học. Ví dụ như, hai nguyên tử natri (Na) và clo (Cl) khi kết hợp với nhau sẽ tạo thành natri clorua (NaCl), nhờ vào cách chúng tương tác qua việc trao đổi electron.
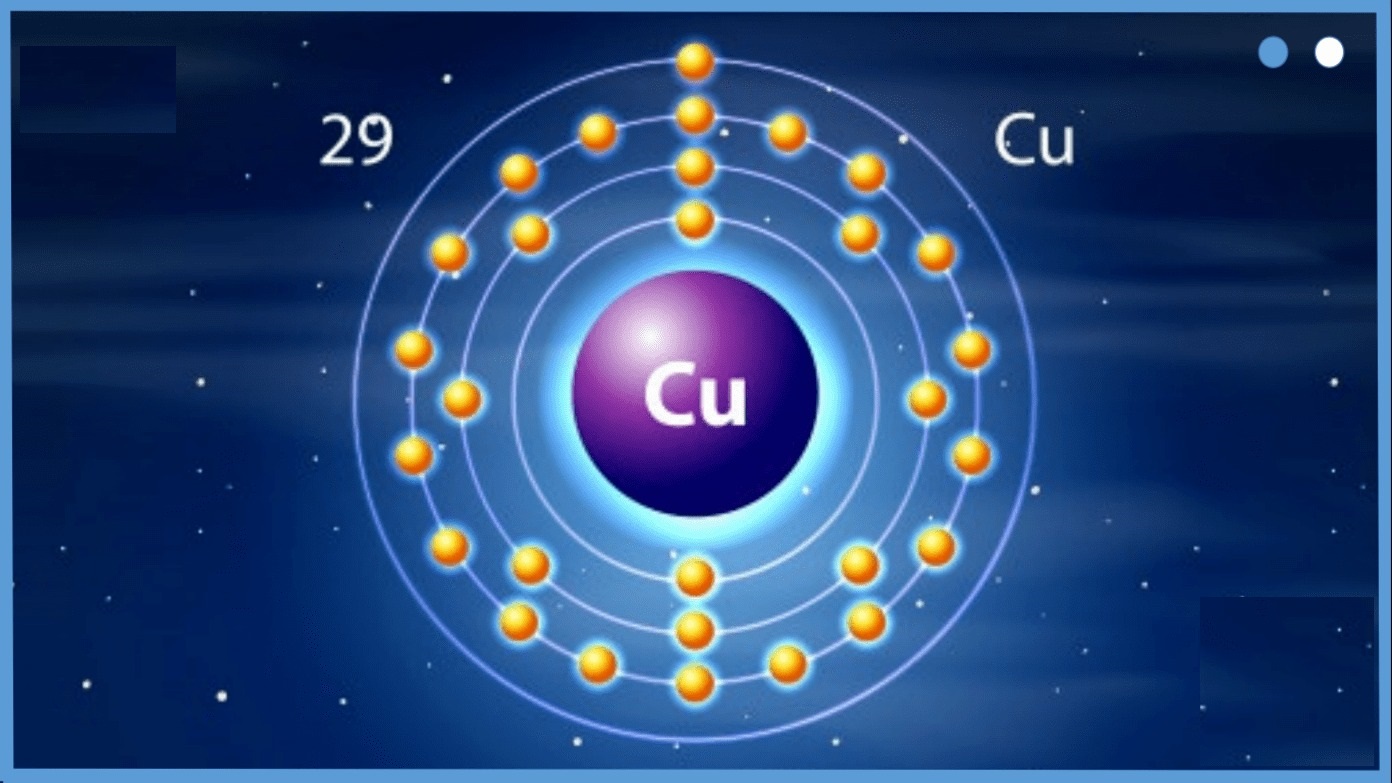
Tại sao cấu hình electron lại quan trọng?
Thêm vào đó, cấu hình electron cũng ảnh hưởng đến năng lượng và sự ổn định của nguyên tử. Các nguyên tử có cấu hình e đầy đủ thường rất ổn định và ít chịu tác động từ môi trường bên ngoài. Ngược lại, những nguyên tử với lớp ngoài cùng không đầy đủ thường dễ dàng mất hoặc nhận electron để đạt được sự ổn định. Có thể tóm gọn sự quan trọng của cấu hình e qua các ý như sau:
-
Tính chất hóa học: Cấu hình e quyết định cách một nguyên tử tương tác với các nguyên tử khác, từ đó xác định tính chất hóa học của nguyên tố.
-
Bảng tuần hoàn: Cấu hình e giúp chúng ta hiểu về sự sắp xếp các nguyên tố trong bảng tuần hoàn và mối quan hệ giữa chúng.
-
Liên kết hóa học: Cấu hình e giúp giải thích sự hình thành liên kết hóa học giữa các nguyên tử.
Cách viết cấu hình electron
Việc viết cấu hình electron chủ yếu tuân theo nguyên tắc di chuyển từ lớp thấp đến lớp cao; điều này giúp chúng ta có thể dễ dàng mô tả cấu hình của một nguyên tử bất kỳ. Đầu tiên, chúng ta cần xác định số hiệu nguyên tử (Z), cho biết tổng số electron trong nguyên tử. Sau đó, dựa vào quy tắc chúng ta sẽ điền electron vào từng lớp theo thứ tự năng lượng từ thấp đến cao. Các lớp electron được phân tách thành những phân lớp như s, p, d, f, mỗi phân lớp lại có quy định về số lượng electron tối đa mà nó có thể chứa.
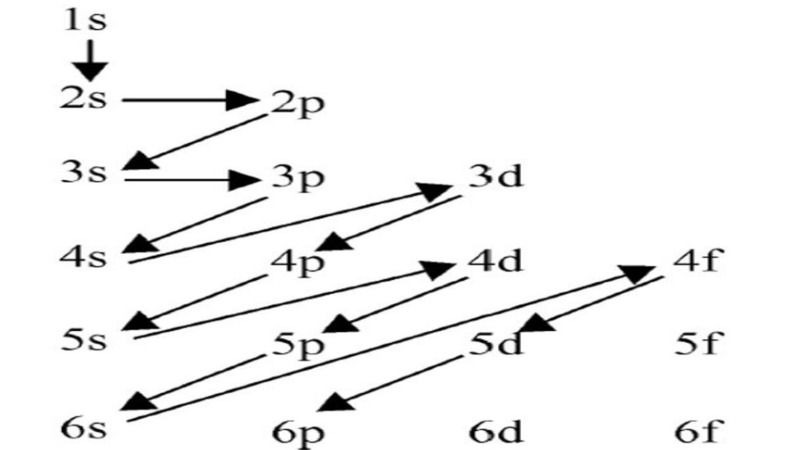
Cách viết cấu hình electron
|
Phân lớp
|
Số lượng electron tối đa
|
|
s
|
2
|
|
p
|
6
|
|
d
|
10
|
|
f
|
14
|
Chúng ta cũng cần tuân thủ các nguyên lý trong cách viết cấu hình e như sau;
-
Nguyên lý Aufbau: Electron sẽ điền vào các orbital có năng lượng thấp nhất trước.
-
Nguyên lý Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và chúng phải có spin đối nhau.
-
Quy tắc Hund: Khi điền electron vào các orbital có cùng năng lượng, electron sẽ phân bố sao cho số electron độc thân là lớn nhất.
Ví dụ: Cấu hình electron của nguyên tử natri (Na) có 11 electron là: 1s² 2s² 2p⁶ 3s¹.
-
1s²: Có 2 electron ở lớp thứ nhất, orbital s.
-
2s²: Có 2 electron ở lớp thứ hai, orbital s.
-
2p⁶: Có 6 electron ở lớp thứ hai, orbital p.
-
3s¹: Có 1 electron ở lớp thứ ba, orbital s.
Ý nghĩa của các lớp electron
Các lớp electron không chỉ là đơn vị cấu trúc phân tử đơn giản mà còn chứa đựng nhiều thông điệp quan trọng về khả năng tương tác hóa học của các nguyên tố. Mỗi lớp được ký hiệu bằng một số nguyên (n = 1, 2, 3,...) và mỗi lớp lại được chia nhỏ thành các phân lớp (s, p, d, f). Các lớp ngoài cùng thường được coi là quan trọng nhất vì chúng quyết định tính chất hóa học của nguyên tố.
-
Lớp K (n=1): Lớp gần hạt nhân nhất, chứa tối đa 2 electron.
-
Lớp L (n=2): Lớp thứ hai, chứa tối đa 8 electron.
-
Lớp M (n=3): Lớp thứ ba, chứa tối đa 18 electron.
-
...
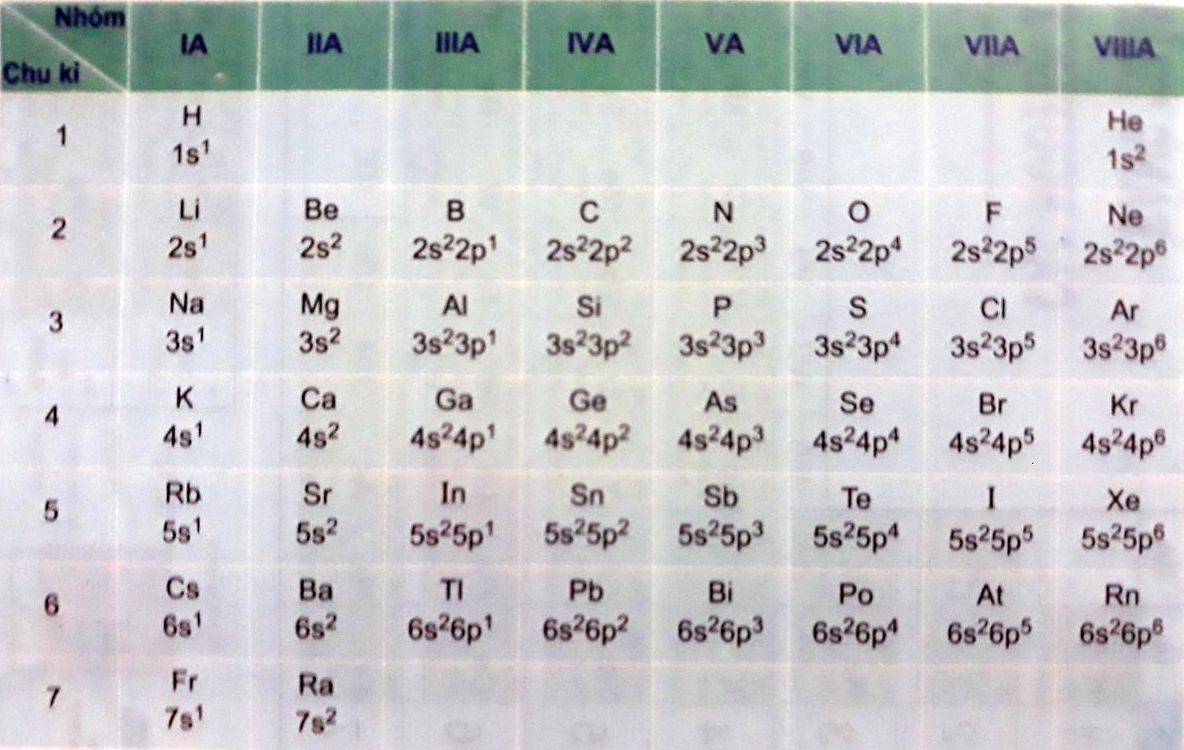
Cấu hình electron rút gọn
Cấu hình electron rút gọn là một cách thức rất hữu ích để đơn giản hóa việc mô tả cấu hình electron, nhưng vẫn giữ nguyên thông tin cần thiết. Thay vì viết toàn bộ các lớp và phân lớp, chúng ta có thể bắt đầu từ khí hiếm gần nhất có số hiệu nguyên tử thấp hơn và sau đó viết tiếp các electron còn lại.
Chẳng hạn, đối với nguyên tử khí argon (Ar) với số hiệu nguyên tử 18, cấu hình electron đầy đủ của nó là 1s² 2s² 2p⁶ 3s² 3p⁶. Tuy nhiên, cấu hình electron rút gọn sẽ là [Ne] 3s² 3p⁶, trong đó [Ne] chỉ ra rằng chúng ta bắt đầu từ helium trước đó.
Cấu hình electron rút gọn
|
Nguyên tử
|
Cấu hình electron rút gọn
|
|
Carbon
|
[He] 2s² 2p²
|
|
Oxy
|
[He] 2s² 2p⁴
|
|
Natri
|
[Ne] 3s¹
|
|
Clo
|
[Ne] 3s² 3p⁵
|
Việc sử dụng cách viết này giúp hệ thống hóa và tiết kiệm không gian cho các bảng cấu hình. Hơn nữa, cấu hình electron rút gọn cũng giúp chúng ta dễ dàng hơn trong việc nhận diện và phân tích các nguyên tố.
Tìm hiểu về các Orbital
Orbital là một khái niệm quan trọng trong hóa học, dùng để mô tả vùng không gian xung quanh hạt nhân nơi mà xác suất tìm thấy electron là lớn nhất. Hãy hình dung orbital như một đám mây electron bao quanh hạt nhân, mỗi đám mây có hình dạng và kích thước khác nhau.
Orbital có nhiều hình dạng khác nhau, tùy thuộc vào loại orbital. Các loại orbital chính bao gồm:
-
Orbital s: Có hình cầu, đối xứng quanh hạt nhân.
-
Orbital p: Có hình số 8 nằm ngang, gồm 3 orbital px, py, pz vuông góc nhau.
-
Orbital d: Có hình phức tạp hơn, gồm 5 orbital.
-
Orbital f: Có hình dạng còn phức tạp hơn nữa, gồm 7 orbital.
Mỗi orbital có một mức năng lượng xác định. Các electron sẽ điền vào các orbital từ thấp đến cao theo nguyên lý Aufbau.
Ví dụ
-
Nguyên tử Hydro: Electron duy nhất của nguyên tử Hydro nằm trong orbital 1s (orbital s ở lớp thứ nhất).
-
Nguyên tử Carbon: Cấu hình electron của Carbon là 1s² 2s² 2p². Điều này có nghĩa là Carbon có 2 electron ở orbital 1s, 2 electron ở orbital 2s và 2 electron ở orbital 2p.
Tổng kết lại, cấu hình electron không chỉ là một phần kiến thức lý thuyết trong hóa học mà còn là một công cụ mạnh mẽ để giải thích và dự đoán tính chất của nguyên tố trong tự nhiên. Đong Á mong rằng việc hiểu rõ cấu hình electron giúp chúng ta có cái nhìn sâu sắc hơn về cách mà các nguyên tử tương tác với nhau, điều này ảnh hưởng đến mọi thứ từ phản ứng hóa học hàng ngày cho đến các ứng dụng công nghệ hiện đại như trong ngành bán dẫn và hóa học vật liệu.