Cân bằng hóa học là một trong những chủ đề cốt lõi trong hóa học, đóng vai trò quan trọng trong việc hiểu biết về cách mà các phản ứng hóa học diễn ra trong tự nhiên cũng như trong sản xuất công nghiệp. Từ những phản ứng đơn giản như sự hòa tan của đường trong nước cho đến những quy trình phức tạp như tổng hợp amoniac, tất cả đều tuân theo các nguyên tắc của cân bằng hóa học. Bài viết này sẽ đi sâu vào những khía cạnh của cân bằng hóa học, giúp bạn không chỉ nắm bắt được khái niệm mà còn ứng dụng vào thực tế.
Khái niệm cân bằng hóa học là gì?
Cân bằng hóa học là trạng thái của một phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. Nói cách khác, ở trạng thái cân bằng, lượng chất phản ứng và sản phẩm không thay đổi theo thời gian mặc dù phản ứng vẫn tiếp tục diễn ra.
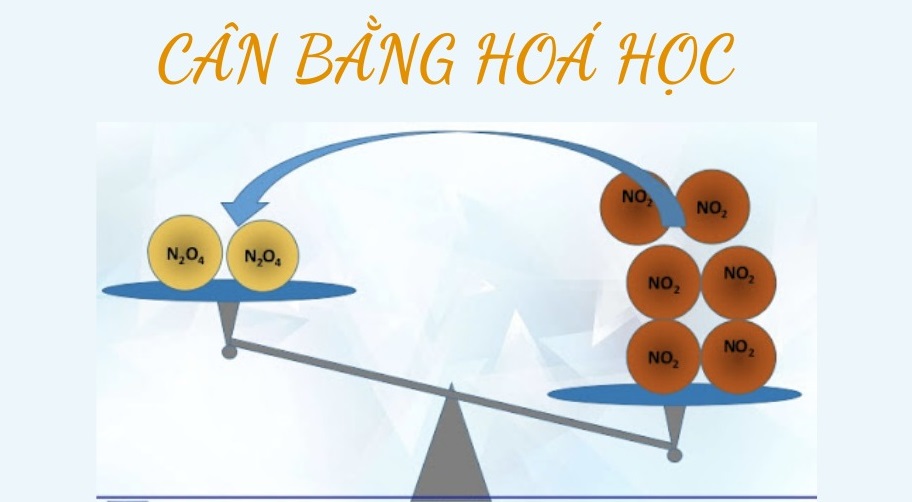
Khái niệm cân bằng hóa học là gì?
Đặc điểm của cân bằng hóa học
-
Tính động: Phản ứng thuận nghịch vẫn diễn ra liên tục ở cả hai chiều nhưng với tốc độ bằng nhau.
-
Tính khả nghịch: Phản ứng có thể xảy ra theo cả hai chiều: từ chất phản ứng tạo thành sản phẩm và ngược lại.
-
Tính cân bằng: Lượng chất phản ứng và sản phẩm không thay đổi theo thời gian.
Vì sao có cân bằng hóa học?
Cân bằng hóa học xảy ra do sự va chạm ngẫu nhiên giữa các phân tử. Khi các phân tử va chạm với đủ năng lượng và định hướng thích hợp, chúng sẽ phản ứng với nhau tạo thành sản phẩm. Đồng thời, các phân tử sản phẩm cũng có thể va chạm và kết hợp lại để tạo thành chất phản ứng. Khi tốc độ của hai quá trình này bằng nhau, hệ đạt trạng thái cân bằng.
Yếu tố ảnh hưởng đến cân bằng hóa học

Yếu tố ảnh hưởng đến cân bằng hóa học
Một số yếu tố có thể làm thay đổi vị trí cân bằng của một phản ứng hóa học:
-
Nồng độ: Tăng nồng độ của một chất sẽ làm cân bằng chuyển dịch theo chiều làm giảm nồng độ của chất đó.
-
Áp suất: Đối với các phản ứng có chất khí tham gia, tăng áp suất sẽ làm cân bằng chuyển dịch theo chiều làm giảm số mol khí.
-
Nhiệt độ:
-
Chất xúc tác: Chất xúc tác làm tăng tốc độ của cả phản ứng thuận và nghịch nên không làm thay đổi vị trí cân bằng mà chỉ làm cho cân bằng đạt được nhanh hơn.
Ý nghĩa của cân bằng hóa học
Cân bằng hóa học có ý nghĩa rất quan trọng trong nhiều lĩnh vực, đặc biệt là hóa học công nghiệp. Việc hiểu và điều khiển cân bằng hóa học giúp:
-
Tối ưu hóa hiệu suất phản ứng: Bằng cách điều chỉnh các yếu tố ảnh hưởng, ta có thể tăng lượng sản phẩm mong muốn.
-
Sản xuất các chất hóa học: Nhiều quá trình sản xuất hóa chất dựa trên việc điều khiển cân bằng hóa học.
-
Nghiên cứu các quá trình tự nhiên: Cân bằng hóa học đóng vai trò quan trọng trong nhiều quá trình tự nhiên như quang hợp, hô hấp.
Các loại cân bằng hóa học
Cân bằng hóa học là một trạng thái động của một phản ứng thuận nghịch, khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. Tuy nhiên, tùy thuộc vào điều kiện và bản chất của phản ứng, cân bằng hóa học có thể được phân loại thành các loại khác nhau.
Có nhiều loại cân bằng hóa học khác nhau
1. Cân bằng Đồng thể
-
Định nghĩa: Cân bằng đồng thể là cân bằng trong đó tất cả các chất tham gia phản ứng đều tồn tại trong cùng một pha (khí, lỏng hoặc rắn).
-
Ví dụ: Phản ứng giữa khí hidro và iot để tạo thành khí hydro iotua: H₂(g) + I₂(g) ⇌ 2HI(g)
-
Đặc điểm: Dễ dàng thay đổi vị trí cân bằng bằng cách thay đổi nồng độ, áp suất hoặc nhiệt độ của các chất tham gia.
2. Cân bằng Dị thể
-
Định nghĩa: Cân bằng dị thể là cân bằng trong đó các chất tham gia phản ứng tồn tại ở các pha khác nhau.
-
Ví dụ: Phản ứng giữa canxi cacbonat rắn và khí cacbonic để tạo thành canxi oxit rắn: CaCO₃(r) ⇌ CaO(r) + CO₂(g)
-
Đặc điểm: Chỉ có nồng độ của các chất ở pha khí mới ảnh hưởng đến vị trí cân bằng.
3. Cân bằng Ion
-
Định nghĩa: Cân bằng ion là cân bằng xảy ra trong các dung dịch điện li, liên quan đến sự phân li và kết hợp của các ion.
-
Ví dụ: Sự phân li của axit axetic trong nước: CH₃COOH(aq) ⇌ CH₃COO⁻(aq) + H⁺(aq)
-
Đặc điểm: Thường được biểu diễn bằng hằng số cân bằng ion hóa (Ka, Kb).
4. Cân bằng Đồng phân
5. Cân bằng Hệ thống Nhiều Pha
-
Định nghĩa: Cân bằng hệ thống nhiều pha là cân bằng xảy ra trong các hệ thống có nhiều hơn hai pha.
-
Ví dụ: Cân bằng giữa hơi nước, nước lỏng và băng.
-
Đặc điểm: Phức tạp hơn các loại cân bằng khác và thường được mô tả bằng các phương trình nhiệt động lực học.
Ứng dụng của cân bằng hóa học
Cân bằng hóa học là một khái niệm nền tảng trong hóa học, có vai trò quan trọng trong nhiều lĩnh vực của đời sống. Việc hiểu và ứng dụng cân bằng hóa học giúp chúng ta tối ưu hóa các quá trình sản xuất, giải quyết các vấn đề môi trường và khám phá các hiện tượng tự nhiên.
Ứng dụng của cân bằng hóa học
1. Công nghiệp hóa chất:
-
Sản xuất amoniac: Quá trình Haber-Bosch sản xuất amoniac từ nitơ và hydro là một ví dụ điển hình về việc ứng dụng cân bằng hóa học để tối ưu hóa hiệu suất sản xuất. Bằng cách điều chỉnh nhiệt độ, áp suất và chất xúc tác, người ta có thể tăng lượng amoniac thu được.
-
Sản xuất axit sulfuric: Quá trình tiếp xúc là một quá trình công nghiệp quan trọng để sản xuất axit sulfuric. Cân bằng hóa học được sử dụng để điều khiển các giai đoạn khác nhau trong quá trình này.
-
Sản xuất các hợp chất hữu cơ: Nhiều phản ứng hữu cơ là các phản ứng thuận nghịch. Việc hiểu và điều khiển cân bằng hóa học giúp tăng hiệu suất sản xuất các hợp chất hữu cơ.
2. Công nghiệp luyện kim:
3. Ngành môi trường:
-
Xử lý nước thải: Quá trình xử lý nước thải thường liên quan đến các phản ứng cân bằng hóa học để loại bỏ các chất ô nhiễm.
-
Giảm thiểu khí thải: Các quá trình công nghiệp thường thải ra các khí độc hại. Việc hiểu cân bằng hóa học giúp thiết kế các hệ thống xử lý khí thải hiệu quả.
4. Sinh học:
-
Quang hợp: Quá trình quang hợp là một chuỗi các phản ứng cân bằng hóa học, trong đó năng lượng ánh sáng được chuyển hóa thành năng lượng hóa học trong các phân tử hữu cơ.
-
Hô hấp: Quá trình hô hấp tế bào cũng là một quá trình cân bằng hóa học, cung cấp năng lượng cho các hoạt động sống của cơ thể.
5. Ngành dược phẩm:
6. Thực phẩm:
-
Lên men: Quá trình lên men rượu, sữa chua, tương... là những ví dụ về cân bằng hóa học trong thực phẩm.
-
Bảo quản thực phẩm: Các quá trình ôi thiu, lên men thực phẩm đều liên quan đến các phản ứng cân bằng hóa học.
Phương pháp cân bằng phương trình hóa học
Cân bằng phương trình hóa học là một kỹ năng quan trọng trong hóa học, giúp ta biểu diễn chính xác một phản ứng hóa học. Có nhiều phương pháp để cân bằng phương trình, mỗi phương pháp có ưu điểm và phù hợp với các loại phản ứng khác nhau.

Phương pháp cân bằng phương trình hóa học
1. Phương pháp Thử và Sai
-
Nguyên tắc: Bằng cách thử các hệ số khác nhau trước các công thức hóa học, ta tìm ra bộ hệ số làm cho số nguyên tử của mỗi nguyên tố ở hai vế bằng nhau.
-
Ưu điểm: Đơn giản, dễ hiểu.
-
Nhược điểm: Tốn thời gian, đặc biệt với các phương trình phức tạp.
2. Phương pháp Đại số
-
Nguyên tắc: Gán các ẩn số cho các hệ số chưa biết, lập hệ phương trình dựa trên sự bằng nhau số nguyên tử của mỗi nguyên tố ở hai vế, sau đó giải hệ phương trình để tìm giá trị các ẩn.
-
Ưu điểm: Chính xác, đặc biệt hữu ích với các phương trình phức tạp.
-
Nhược điểm: Cần kiến thức về giải hệ phương trình.
3. Phương pháp Bán Phản ứng
-
Nguyên tắc: Chia phản ứng thành hai nửa phản ứng: quá trình oxi hóa và quá trình khử. Cân bằng mỗi nửa phản ứng riêng biệt rồi cộng lại để được phương trình cân bằng.
-
Ưu điểm: Dễ áp dụng cho các phản ứng oxi hóa khử.
-
Nhược điểm: Có thể phức tạp với các phản ứng có nhiều quá trình oxi hóa khử.
4. Phương pháp Ion-Electron
-
Nguyên tắc: Tương tự phương pháp bán phản ứng, nhưng sử dụng ion để biểu diễn các quá trình oxi hóa khử trong dung dịch.
-
Ưu điểm: Dùng để cân bằng các phương trình ion trong dung dịch.
-
Nhược điểm: Cần nắm vững các quy tắc viết ion và cân bằng điện tích.
Các vấn đề thường gặp trong cân bằng hóa học
Cân bằng hóa học là một khái niệm quan trọng trong hóa học, tuy nhiên, trong quá trình học tập và ứng dụng, chúng ta thường gặp một số vấn đề. Dưới đây là một số vấn đề thường gặp và cách giải quyết chúng:
1. Khó khăn trong việc hiểu khái niệm cân bằng động:
2. Nhầm lẫn giữa hằng số cân bằng Kc và Kp:
3. Khó khăn trong việc áp dụng nguyên lý Le Chatelier:
4. Khó khăn trong việc tính toán hằng số cân bằng và nồng độ các chất tại trạng thái cân bằng:
5. Ứng dụng thực tế của cân bằng hóa học:
Lời khuyên:
-
Học bằng cách làm bài tập: Càng làm nhiều bài tập, bạn càng nắm vững kiến thức và kỹ năng.
-
Sử dụng các công cụ hỗ trợ: Có thể sử dụng các phần mềm mô phỏng, video để trực quan hóa các quá trình hóa học.
-
Tham gia các diễn đàn, nhóm học tập: Trao đổi với các bạn cùng học để giải đáp thắc mắc.
Qua bài viết trên của hóa chất Đông Á có thể thấy cân bằng hóa học là một khái niệm cốt lõi trong hóa học, giúp giải thích sự tương tác giữa các chất phản ứng và sản phẩm. Hiểu rõ về cân bằng hóa học không chỉ giúp cải thiện khả năng dự đoán và điều khiển các phản ứng hóa học mà còn mở ra nhiều cơ hội ứng dụng thực tế trong công nghiệp, môi trường và y học. Việc áp dụng các nguyên lý của cân bằng hóa học vào thực tế không chỉ nâng cao hiệu quả sản xuất mà còn đảm bảo an toàn và bền vững trong nhiều lĩnh vực khác nhau. Chính vì vậy, nghiên cứu sâu về cân bằng hóa học không chỉ giúp ích cho các nhà khoa học mà còn cho toàn xã hội trong việc cải tiến và phát triển bền vững.