Phản ứng hóa học là một trong những phần cơ bản và thú vị nhất của ngành hóa học, nơi mọi thứ từ những nguyên tố đơn giản nhất cho đến các hợp chất phức tạp có thể tương tác và biến đổi lẫn nhau. Hiểu rõ về các loại phản ứng hóa học không chỉ giúp chúng ta có cái nhìn sâu sắc hơn về các hiện tượng xung quanh mà còn hỗ trợ chúng ta trong việc ứng dụng chúng vào thực tiễn một cách hiệu quả. Bài viết này, Đông Á Chemical sẽ đem đến cho bạn cái nhìn tường tận về các loại phản ứng hóa học, từ phản ứng hóa hợp đơn giản cho đến những phản ứng phức tạp như oxi hóa-khử.
Điểm danh các loại phản ứng hóa học điển hình
Phản ứng hóa học là quá trình biến đổi chất này thành chất khác. Có rất nhiều loại phản ứng hóa học khác nhau, nhưng chúng ta có thể phân loại chúng thành một số nhóm chính dựa trên sự thay đổi về liên kết hóa học và các đặc trưng khác.
1. Phản ứng hóa hợp
Phản ứng hóa hợp
2. Phản ứng phân hủy
3. Phản ứng thế

Phản ứng thế
4. Phản ứng trao đổi
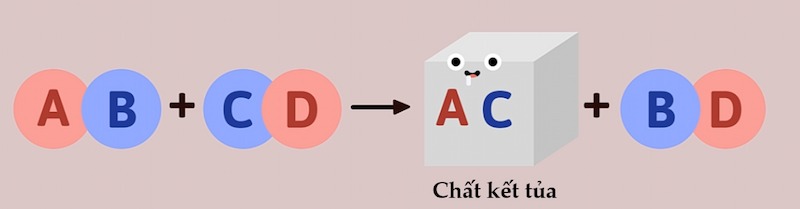
Phản ứng trao đổi
5. Phản ứng oxi hóa - khử
Việc phân loại các phản ứng hóa học giúp chúng ta hiểu rõ hơn về bản chất của các quá trình hóa học và dự đoán được sản phẩm tạo thành. Tuy nhiên, nhiều phản ứng hóa học có thể thuộc nhiều loại khác nhau.
Tính ứng dụng và vai trò của các loại phản ứng hóa học
Các phản ứng hóa học đóng vai trò cực kỳ quan trọng trong cuộc sống hàng ngày, trong công nghiệp và trong tự nhiên. Dưới đây là một số ứng dụng điển hình của từng loại phản ứng:

Tính ứng dụng và vai trò của các loại phản ứng hóa học
1. Phản ứng hóa hợp
-
Sản xuất các hợp chất: Được sử dụng để tạo ra nhiều hợp chất quan trọng như nước, axit sunfuric, amoniac,...
-
Quá trình cháy: Phản ứng cháy của nhiên liệu (ví dụ: đốt gas, đốt củi) là một ví dụ điển hình của phản ứng hóa hợp.
-
Tổng hợp vật liệu: Được sử dụng để tạo ra nhiều loại vật liệu mới như nhựa, cao su,...
2. Phản ứng phân hủy
-
Sản xuất khí: Nhiều khí quan trọng như oxi, khí cacbonic được sản xuất bằng cách phân hủy các hợp chất.
-
Chế biến thực phẩm: Quá trình lên men để tạo ra rượu, sữa chua, pho mát cũng là một dạng phản ứng phân hủy.
-
Sản xuất kim loại: Nhiều kim loại được sản xuất bằng cách phân hủy các hợp chất của chúng.
3. Phản ứng thế
-
Sản xuất kim loại: Nhiều kim loại được sản xuất bằng cách dùng các chất khử mạnh đẩy kim loại ra khỏi hợp chất của nó.
-
Mạ điện: Quá trình mạ điện dựa trên phản ứng thế để phủ một lớp kim loại lên bề mặt kim loại khác.
-
Pin điện hóa: Pin hoạt động dựa trên phản ứng thế giữa các chất.
4. Phản ứng trao đổi
-
Sản xuất muối: Nhiều loại muối được sản xuất bằng phản ứng trao đổi giữa các dung dịch muối.
-
Xử lý nước: Quá trình làm mềm nước cứng cũng dựa trên phản ứng trao đổi.
-
Tổng hợp hữu cơ: Nhiều phản ứng hữu cơ là các phản ứng trao đổi.
5. Phản ứng oxi hóa - khử
-
Sản xuất năng lượng: Phản ứng đốt cháy nhiên liệu để sản xuất điện là một ví dụ điển hình.
-
Pin và ắc quy: Hoạt động dựa trên phản ứng oxi hóa - khử.
-
Công nghiệp luyện kim: Quá trình khử oxit kim loại để thu được kim loại tinh khiết.
-
Sự sống: Quá trình hô hấp tế bào là một loạt các phản ứng oxi hóa - khử.
Vai trò chung:
-
Trong tự nhiên: Các phản ứng hóa học là nền tảng của mọi quá trình tự nhiên, từ sự hình thành các khoáng chất cho đến sự sống của sinh vật.
-
Trong công nghiệp: Các phản ứng hóa học được sử dụng để sản xuất hàng loạt sản phẩm, từ hóa chất, vật liệu xây dựng đến các sản phẩm tiêu dùng.
-
Trong đời sống: Các phản ứng hóa học xảy ra trong quá trình nấu ăn, tiêu hóa thức ăn, sử dụng các sản phẩm tẩy rửa,...
So sánh các loại phản ứng hóa học
Các loại phản ứng hóa học mà chúng ta đã đề cập đều có những đặc điểm riêng biệt, nhưng cũng có những điểm chung và sự liên kết nhất định. Để hiểu rõ hơn về sự khác biệt và điểm tương đồng giữa các loại phản ứng này, chúng ta hãy cùng so sánh:
Bảng so sánh các loại phản ứng hóa học:
|
Loại phản ứng
|
Phương trình tổng quát
|
Đặc điểm chính
|
Ví dụ điển hình
|
|
Hóa hợp
|
A + B → AB
|
Hai hay nhiều chất kết hợp thành một chất
|
2Mg + O₂ → 2MgO
|
|
Phân hủy
|
AB → A + B
|
Một chất phân hủy thành hai hay nhiều chất
|
2KClO₃ → 2KCl + 3O₂
|
|
Thế
|
A + BC → AC + B
|
Nguyên tử của một đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất
|
Zn + 2HCl → ZnCl₂ + H₂
|
|
Trao đổi
|
AB + CD → AD + CB
|
Các chất tham gia trao đổi cho nhau thành phần cấu tạo
|
AgNO₃ + NaCl → AgCl↓ + NaNO₃
|
|
Oxi hóa - khử
|
Đa dạng
|
Có sự chuyển dịch electron, thay đổi số oxi hóa
|
2Fe + 3Cl₂ → 2FeCl₃
|
Điểm giống và khác nhau
-
Điểm giống:
-
Đều là quá trình biến đổi chất này thành chất khác.
-
Đều tuân theo định luật bảo toàn khối lượng.
-
Đều có thể tỏa nhiệt hoặc thu nhiệt.
-
Điểm khác:
-
Số lượng chất tham gia và sản phẩm: Phản ứng hóa hợp có số lượng chất sản phẩm ít hơn, phản ứng phân hủy thì ngược lại.
-
Sự thay đổi liên kết: Mỗi loại phản ứng có sự thay đổi liên kết hóa học khác nhau.
-
Sự thay đổi số oxi hóa: Phản ứng oxi hóa - khử luôn có sự thay đổi số oxi hóa, trong khi các loại khác có thể có hoặc không.
Quan hệ giữa các loại phản ứng
-
Phản ứng oxi hóa - khử: Là loại phản ứng rộng nhất, bao gồm cả các loại phản ứng khác. Ví dụ, phản ứng hóa hợp của kim loại với oxi cũng là một phản ứng oxi hóa - khử.
-
Các loại phản ứng khác: Có thể xem như là các trường hợp đặc biệt của phản ứng oxi hóa - khử.
Lưu ý quan trọng
-
Sự phân loại không tuyệt đối: Một phản ứng hóa học có thể thuộc nhiều loại khác nhau.
-
Điều kiện phản ứng: Điều kiện phản ứng (nhiệt độ, áp suất, chất xúc tác) có thể ảnh hưởng đến loại phản ứng xảy ra.
Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Tốc độ phản ứng hóa học là một khái niệm quan trọng trong hóa học, nó cho biết sự nhanh chậm của một phản ứng. Tốc độ phản ứng có thể bị ảnh hưởng bởi nhiều yếu tố khác nhau. Hãy cùng tìm hiểu chi tiết từng yếu tố nhé!
Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
1. Nồng độ
-
Nguyên tắc: Nồng độ của chất tham gia phản ứng càng lớn, tốc độ phản ứng càng nhanh.
-
Giải thích: Khi nồng độ tăng, số lượng các hạt va chạm trong một đơn vị thể tích tăng lên, làm tăng khả năng xảy ra va chạm hiệu quả, từ đó tăng tốc độ phản ứng.
-
Ví dụ: Khi đốt một que diêm trong không khí, nếu tăng nồng độ oxi bằng cách thổi mạnh, que diêm sẽ cháy sáng hơn và nhanh hơn.
2. Nhiệt độ
-
Nguyên tắc: Nhiệt độ càng cao, tốc độ phản ứng càng nhanh.
-
Giải thích: Khi nhiệt độ tăng, các phân tử chuyển động nhanh hơn, năng lượng trung bình của các phân tử tăng lên, làm tăng số lượng các va chạm hiệu quả và tăng khả năng phá vỡ các liên kết cũ để tạo thành liên kết mới.
-
Ví dụ: Thức ăn nấu chín nhanh hơn khi đun ở nhiệt độ cao.
3. Áp suất (Đối với phản ứng có chất khí)
-
Nguyên tắc: Đối với phản ứng có chất khí, khi tăng áp suất, tốc độ phản ứng tăng.
-
Giải thích: Khi tăng áp suất, số phân tử khí trong một đơn vị thể tích tăng lên, làm tăng tần suất va chạm giữa các phân tử, từ đó tăng tốc độ phản ứng.
-
Ví dụ: Phản ứng tổng hợp amoniac từ nitơ và hidro diễn ra nhanh hơn ở áp suất cao.
4. Diện tích tiếp xúc
-
Nguyên tắc: Diện tích tiếp xúc giữa các chất phản ứng càng lớn, tốc độ phản ứng càng nhanh.
-
Giải thích: Diện tích tiếp xúc lớn giúp tăng số lượng các hạt tiếp xúc và va chạm, từ đó tăng tốc độ phản ứng.
-
Ví dụ: Việc đập nhỏ than trước khi đốt giúp than cháy nhanh hơn.
5. Chất xúc tác
-
Nguyên tắc: Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng không bị biến đổi về lượng sau phản ứng.
-
Giải thích: Chất xúc tác làm giảm năng lượng hoạt hóa của phản ứng, giúp các phân tử dễ dàng vượt qua hàng rào năng lượng để chuyển hóa thành sản phẩm.
-
Ví dụ: Enzim trong cơ thể người là chất xúc tác sinh học giúp các phản ứng sinh hóa diễn ra nhanh chóng.
6. Bản chất của chất phản ứng
-
Nguyên tắc: Tính chất hóa học của các chất tham gia phản ứng cũng ảnh hưởng đến tốc độ phản ứng.
-
Giải thích: Các chất khác nhau có cấu trúc phân tử khác nhau, dẫn đến khả năng phản ứng khác nhau.
-
Ví dụ: Kim loại kiềm phản ứng với nước nhanh hơn so với kim loại kiềm thổ.
Qua bài viết trên của Đông Á Chemical có thể thấy những hiểu biết về các loại phản ứng hóa học cùng với tác động của chúng đến tốc độ phản ứng thật sự là nỗi niềm chờ đợi của những ai yêu thích môn hóa học. Hóa học không chỉ đơn thuần là các phản ứng đang diễn ra mà còn là những cơ hội vô tận để chúng ta khám phá và sáng tạo ra những điều mới mẻ.