Axit clohidric (HCl) là một axit mạnh, có tính ăn mòn cao và được sử dụng rộng rãi trong nhiều ngành công nghiệp. Đặc tính nổi bật của HCl là khả năng phản ứng với nhiều loại chất khác nhau, tạo ra các sản phẩm mới. Trong bài viết dưới đây Đông Á Chemical sẽ chia sẻ tới bạn các chất tác dụng với HCl cùng những ứng dụng phổ biến của axit này trong đời sống.
Tại sao HCl lại phản ứng với nhiều chất?
HCl (axit clohidric) là một axit mạnh, có tính phân cực cao và khả năng ion hóa mạnh. Chính những đặc điểm này đã khiến HCl có khả năng phản ứng với rất nhiều chất khác nhau. Lý giải chi tiết
-
Tính axit mạnh:
- HCl khi tan trong nước phân ly hoàn toàn thành ion H+ và ion Cl-. Ion H+ là nguyên nhân chính gây ra tính axit.
- Ion H+ có khả năng kết hợp với nhiều loại ion âm khác nhau để tạo thành muối, giải phóng năng lượng và làm cho phản ứng xảy ra.
-
Tính phân cực:
- Phân tử HCl có một đầu mang điện tích dương (H+) và một đầu mang điện tích âm (Cl-), tạo thành một phân tử phân cực.
- Tính phân cực này giúp HCl dễ dàng tương tác với các phân tử khác, đặc biệt là các phân tử có tính phân cực hoặc các ion.
-
Khả năng ion hóa mạnh:
- Khi hòa tan trong nước, HCl ion hóa hoàn toàn, tạo ra một lượng lớn ion H+ và Cl-.
- Nồng độ ion H+ cao tạo điều kiện thuận lợi cho các phản ứng hóa học xảy ra.
Tổng hợp các chất tác dụng với HCl
Axit clohidric (HCl) là một axit mạnh, có khả năng tác dụng với nhiều chất khác nhau. Dưới đây là một số loại chất thường gặp tác dụng với HCl:
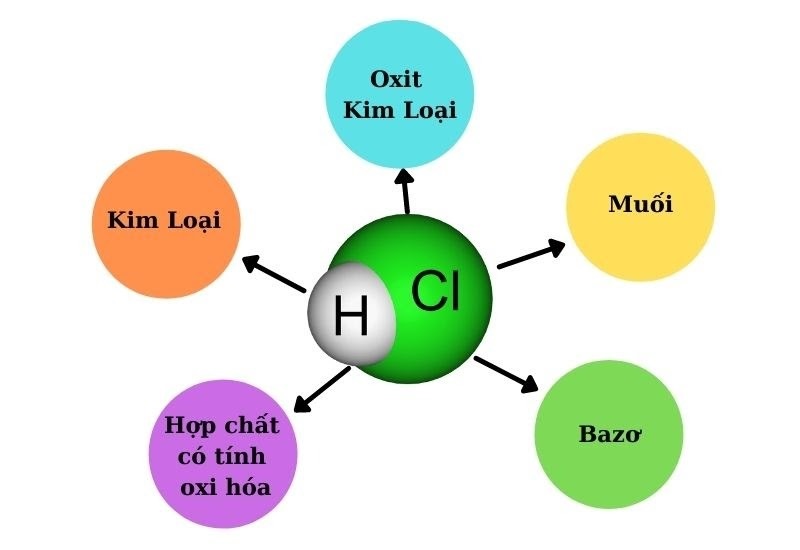
Tổng hợp các chất tác dụng với HCl
1. Kim loại:
Ví dụ:
2. Oxit bazơ:
Ví dụ:
3. Bazơ:
Ví dụ:
4. Muối:
Ví dụ:
5. Chất có tính oxi hóa mạnh:
-
HCl có thể tác dụng với các chất có tính oxi hóa mạnh như KMnO₄, K₂Cr₂O₇, MnO₂, KClO₃... Trong phản ứng này, HCl đóng vai trò là chất khử và bị oxi hóa thành khí clo.
Ví dụ: 2KMnO₄ + 16HCl → 2KCl + 2MnCl₂ + 5Cl₂↑ + 8H₂O
Ứng dụng của axit HCl trong đời sống
Axit clohidric (HCl) là một hợp chất hóa học có tính axit mạnh, đóng vai trò quan trọng trong nhiều ngành công nghiệp và lĩnh vực khác nhau. Dưới đây là một số ứng dụng nổi bật của HCl trong đời sống:
Trong công nghiệp
-
Sản xuất hóa chất: HCl được sử dụng để sản xuất các hợp chất hữu cơ và vô cơ khác, như các muối clorua, vinyl clorua (dùng để sản xuất PVC), và các hợp chất trung gian trong tổng hợp hữu cơ.
-
Xử lý kim loại: HCl được dùng để làm sạch bề mặt kim loại trước khi hàn, mạ, sơn, hoặc các quá trình xử lý khác. Nó giúp loại bỏ các oxit kim loại và tạp chất trên bề mặt.
-
Sản xuất dược phẩm: HCl được sử dụng trong quá trình sản xuất nhiều loại thuốc, như các hợp chất hữu cơ chứa clo, các loại thuốc kháng sinh, và các sản phẩm dược phẩm khác.
-
Xử lý nước: HCl được dùng để điều chỉnh độ pH của nước, loại bỏ các ion kim loại nặng, và xử lý nước thải công nghiệp.
-
Sản xuất thực phẩm: HCl được sử dụng trong quá trình sản xuất một số loại thực phẩm, như đường glucozơ, tinh chế dầu ăn, và sản xuất các chất phụ gia thực phẩm.
Trong đời sống hàng ngày
-
Làm sạch: HCl có thể được sử dụng để làm sạch các bề mặt bẩn, loại bỏ rỉ sét, và làm sạch các thiết bị nhà bếp. Tuy nhiên, cần hết sức cẩn thận khi sử dụng HCl để làm sạch do tính ăn mòn mạnh của nó.
-
Sản xuất đồ gia dụng: HCl được sử dụng trong quá trình sản xuất một số loại đồ gia dụng, như thủy tinh, gốm sứ.
Những lưu ý khi sử dụng axit HCl gồm những gì?
Axit HCl clohidric là một hóa chất có tính ăn mòn mạnh, do đó khi làm việc với HCl, bạn cần tuân thủ nghiêm ngặt các quy tắc an toàn để tránh những tai nạn đáng tiếc. Dưới đây là một số lưu ý quan trọng:
Bảo hộ cá nhân
-
Mắt: Luôn đeo kính bảo hộ hóa học để bảo vệ mắt khỏi các tia bắn tung và hơi axit.
-
Da: Mặc áo bảo hộ dài tay, quần dài, găng tay cao su chịu hóa chất để bảo vệ da khỏi tiếp xúc trực tiếp với axit.
-
Đường hô hấp: Đeo khẩu trang hoặc mặt nạ phòng độc để tránh hít phải hơi axit.
Bảo quản
-
Bình chứa: Sử dụng bình chứa bằng chất liệu chịu axit, có nắp đậy kín để bảo quản HCl.
-
Vị trí: Bảo quản HCl ở nơi khô ráo, thoáng mát, tránh ánh nắng trực tiếp và xa các nguồn nhiệt.
-
Cách xa các chất khác: Không để HCl gần các chất dễ cháy, chất có tính oxy hóa mạnh hoặc các kim loại hoạt động.
Pha loãng
-
Luôn pha loãng HCl: Khi cần pha loãng HCl, luôn rót từ từ HCl vào nước (không bao giờ làm ngược lại) và khuấy đều. Việc pha loãng đột ngột có thể gây ra phản ứng tỏa nhiệt mạnh, gây bỏng.
-
Dụng cụ pha loãng: Sử dụng dụng cụ thủy tinh chịu nhiệt và hóa chất để pha loãng.
Làm việc
-
Thực hiện trong tủ hút: Các thao tác với HCl nên được thực hiện trong tủ hút để hạn chế tiếp xúc với hơi axit.
-
Tránh hít phải hơi axit: Không nghiêng mặt vào bình chứa HCl, tránh hít phải hơi axit.
-
Tránh đổ vỡ: Cẩn thận khi di chuyển bình chứa HCl để tránh đổ vỡ.
Xử lý sự cố
-
Rò rỉ: Nếu xảy ra sự cố rò rỉ, cần nhanh chóng di chuyển người và vật liệu dễ cháy ra khỏi khu vực, thông báo cho người có trách nhiệm và sử dụng các chất trung hòa như dung dịch kiềm để xử lý.
-
Bỏng: Nếu bị HCl bắn vào da hoặc mắt, phải nhanh chóng rửa sạch bằng nước sạch nhiều lần và đến cơ sở y tế gần nhất để được cấp cứu.
Biển báo an toàn
-
Dán nhãn: Tất cả các bình chứa HCl phải được dán nhãn rõ ràng, ghi đầy đủ thông tin về tên hóa chất, nồng độ, ngày sản xuất, hạn sử dụng và các cảnh báo nguy hiểm.
Lưu ý: Axit HCl là một hóa chất nguy hiểm, việc sử dụng không đúng cách có thể gây ra những hậu quả nghiêm trọng. Hãy luôn tuân thủ các quy định an toàn và tham khảo ý kiến của người có chuyên môn khi làm việc với hóa chất này.
Điều kiện xảy ra phản ứng của các chất tác dụng với HCl
Axit clohidric (HCl) là một axit mạnh, có khả năng tác dụng với nhiều chất khác nhau để tạo thành các sản phẩm mới. Tuy nhiên, không phải tất cả các chất đều phản ứng với HCl và điều kiện để phản ứng xảy ra cũng khác nhau tùy thuộc vào từng loại chất.
Điều kiện xảy ra phản ứng của các chất tác dụng với HCl
Các yếu tố ảnh hưởng đến phản ứng của HCl
-
Tính chất của chất tham gia:
-
Kim loại: Các kim loại đứng trước hidro trong dãy hoạt động hóa học (như Fe, Zn, Al...) dễ dàng phản ứng với HCl tạo thành muối clorua và khí hidro.
-
Oxit bazơ: Hầu hết các oxit bazơ đều phản ứng với HCl tạo thành muối clorua và nước.
-
Bazơ: Tất cả các bazơ đều phản ứng với HCl theo phản ứng trung hòa tạo thành muối clorua và nước.
-
Muối: Chỉ một số muối nhất định mới phản ứng với HCl, thường là các muối cacbonat, sunfit hoặc muối của các axit yếu hơn HCl.
-
Chất có tính oxi hóa mạnh: Một số chất có tính oxi hóa mạnh như KMnO4, K2Cr2O7... có thể phản ứng với HCl, trong đó HCl đóng vai trò là chất khử.
-
Nồng độ: Nồng độ của HCl càng cao thì tốc độ phản ứng càng nhanh.
-
Nhiệt độ: Nâng cao nhiệt độ thường làm tăng tốc độ phản ứng.
-
Diện tích tiếp xúc: Điện tích tiếp xúc giữa các chất tham gia càng lớn thì phản ứng càng diễn ra nhanh.
Điều kiện cụ thể cho từng loại chất
-
Kim loại: Điều kiện cần thiết là kim loại phải đứng trước hidro trong dãy hoạt động hóa học.
-
Oxit bazơ: Hầu hết các oxit bazơ đều phản ứng với HCl ở điều kiện thường.
-
Bazơ: Tất cả các bazơ đều phản ứng với HCl ở điều kiện thường.
-
Muối: Để phản ứng xảy ra, sản phẩm tạo thành phải có chất kết tủa, chất khí hoặc chất điện li yếu.
-
Chất có tính oxi hóa mạnh: Phản ứng thường xảy ra ở điều kiện đun nóng và có xúc tác.
Qua bài viết chia sẻ trên của Đông Á Chemical có thể thấy các chất tác dụng với HCl rất đa dạng, cùng với đó là điều kiện phản ứng cũng phụ thuộc vào loạt chất tham gia. Hy vọng bài viết của chúng tôi đã phần nào giúp bạn hiểu rõ hơn về Axit clohidric.