Axit bromhidric, thường được gọi tắt là HBr, là một axit vô cơ mạnh và có vai trò quan trọng trong hóa học và ngành công nghiệp. Với công thức hóa học HBr, nó được hình thành khi khí hydrogen bromide hòa tan trong nước. HBr là một trong những axit halogenhidric và nổi bật với tính chất hóa học mạnh mẽ, có khả năng phân ly hoàn toàn trong dung dịch để tạo ra ion hiđro (H⁺) và brom (Br⁻). Trong bài viết này, chúng ta sẽ cùng nhau tìm hiểu chi tiết về khái niệm axit HBr là gì, tính chất vật lý và hóa học, ứng dụng, phương pháp điều chế, cũng như những lưu ý quan trọng khi làm việc với axit HBr.
Khái niệm và tính của axit HBr là gì?
Axit HBr, còn được biết đến với cái tên axit bromhidric, là một axit mạnh trong nhóm axit halogenhidric, có công thức hóa học là HBr. HBr có khả năng giải phóng ion hiđro H⁺ và brom Br⁻ khi hòa tan trong nước, dẫn đến việc tạo ra dung dịch có pH dưới 7, tức là có tính axit rõ rệt.
Khái niệm
Axit bromhidric (HBr) là một axit vô cơ mạnh, được tạo thành khi hòa tan khí hydro bromide (HBr) trong nước. Nó là một trong những axit vô cơ mạnh nhất được biết đến, mạnh hơn axit clohydric (HCl) nhưng yếu hơn axit iodhydric (HI).
Tính chất vật lý
Axit bromhidric (HBr) là một axit vô cơ mạnh, có những tính chất vật lý đặc trưng sau:

Tính chất vật lý của axit bromhidric
-
Trạng thái: Ở điều kiện thường, HBr tồn tại ở dạng khí không màu, có mùi xốc, nặng hơn không khí.
-
Khả năng tan trong nước: HBr tan rất tốt trong nước, tạo thành dung dịch axit bromhidric. Dung dịch này thường có màu hơi vàng nhạt do chứa một lượng nhỏ brom tự do.
-
Khối lượng riêng: Khối lượng riêng của dung dịch HBr phụ thuộc vào nồng độ, nhưng thường lớn hơn khối lượng riêng của nước.
-
Điểm sôi và điểm nóng chảy: Điểm sôi và điểm nóng chảy của HBr tương đối thấp so với các axit vô cơ khác.
-
Tính ăn mòn: HBr là một chất ăn mòn mạnh, có thể gây bỏng da, mắt và đường hô hấp.
Lưu ý: Các tính chất vật lý này có thể thay đổi tùy thuộc vào nồng độ và nhiệt độ của dung dịch HBr.
Tính chất hóa học
Axit bromhydric (HBr) là một axit vô cơ mạnh, có tính chất hóa học đặc trưng của các axit. Dưới đây là một số phản ứng hóa học đặc trưng của HBr:

Tính chất hóa học của HBr
1. Tác dụng với kim loại
2HBr + Fe → FeBr₂ + H₂
2. Tác dụng với bazơ
HBr phản ứng với bazơ tạo thành muối bromide và nước.
HBr + NaOH → NaBr + H₂O
3. Tác dụng với oxit bazơ
HBr tác dụng với oxit bazơ tạo thành muối bromide và nước.
2HBr + CuO → CuBr₂ + H₂O
4. Tác dụng với muối
HBr có thể tác dụng với một số muối tạo thành muối mới và axit mới, tuân theo quy tắc: axit mạnh đẩy axit yếu ra khỏi muối.
2HBr + Na₂CO₃ → 2NaBr + CO₂ + H₂O
5. Tác dụng với các chất khử mạnh
Ion bromide (Br-) trong HBr có tính khử, có thể bị oxi hóa thành brom (Br₂) khi tác dụng với các chất oxi hóa mạnh như clo, kali permanganat.
2HBr + Cl₂ → 2HCl + Br₂
Tính chất đặc trưng khác
-
Tính ăn mòn: HBr có tính ăn mòn cao, tác dụng với nhiều chất hữu cơ và vô cơ.
-
Tính khử: Ion bromide có tính khử yếu hơn ion iodide (I-) nhưng mạnh hơn ion chloride (Cl-).
Ứng dụng của axit HBr
Axit HBr có một loạt các ứng dụng quan trọng trong nhiều lĩnh vực khác nhau, đặc biệt là trong công nghiệp và hóa học. Một số ứng dụng nổi bật của axit HBr có thể kể đến như sau:

Ứng dụng của axit HBr
-
Ngành Hóa Chất: HBr được sử dụng trong tổng hợp hữu cơ, đặc biệt trong việc điều chế các hợp chất brom hữu cơ và các chất trung gian hóa học. Nó cũng được dùng để sản xuất các muối bromua từ các kim loại như kẽm bromide, calci bromide, natri bromide.
-
Ngành Dược Phẩm: Trong lĩnh vực dược phẩm, axit HBr được ứng dụng trong sản xuất thuốc và điều chế các hợp chất như bromides dùng cho thuốc an thần và thuốc trợ ngủ.
-
Ngành Điện Tử: Axit HBr được sử dụng trong quá trình khắc ăn mòn của các bán dẫn và linh kiện điện tử, giúp sản xuất các sản phẩm điện tử chất lượng cao.
-
Chất Xúc Tác: HBr hoạt động như một chất xúc tác trong một số phản ứng hóa học, giúp tăng cường hiệu suất của các phản ứng tổng hợp hữu cơ.
-
Phân tích Hóa Học: Nó được dùng trong các phương pháp phân tích hóa học để xác định sự hiện diện của các hợp chất brom trong mẫu.
Với những ứng dụng đa dạng trên, HBr không chỉ là một chất hóa học đơn thuần mà còn là một thành phần quan trọng trong rất nhiều quy trình công nghiệp và nghiên cứu khoa học, từ sản xuất đến phân tích hóa học.
Phương pháp điều chế axit HBr
Axit bromhidric (HBr) là một hóa chất quan trọng có nhiều ứng dụng trong công nghiệp và phòng thí nghiệm. Dưới đây là một số phương pháp phổ biến để điều chế HBr:
1. Điều chế trong phòng thí nghiệm:
Br₂ + SO₂ + 2H₂O → H₂SO₄ + 2HBr
PBr₃ + 3H₂O → 3HBr + H₃PO₃
2. Điều chế trong công nghiệp:
H₂ + Br₂ → 2HBr
Lưu ý:
2HBr + H₂SO₄(đặc) → Br₂ + SO₂ + 2H₂O
Ưu điểm và nhược điểm của các phương pháp:
-
Phương pháp sử dụng SO₂: Đơn giản, dễ thực hiện nhưng hiệu suất không cao, tạo ra sản phẩm phụ là axit sunfuric.
-
Phương pháp sử dụng phosphor: Hiệu suất cao hơn phương pháp sử dụng SO₂ nhưng phức tạp hơn.
-
Điện phân dung dịch muối bromide: Phương pháp công nghiệp, cho sản phẩm tinh khiết nhưng đòi hỏi thiết bị chuyên dụng.
-
Phản ứng trực tiếp giữa hidro và brom: Phương pháp đơn giản nhưng cần điều kiện nhiệt độ và áp suất cao.
Lựa chọn phương pháp điều chế phù hợp phụ thuộc vào:
-
Quy mô sản xuất: Phòng thí nghiệm hay công nghiệp.
-
Yêu cầu về độ tinh khiết của sản phẩm.
-
Các thiết bị và hóa chất sẵn có.
Lưu ý khi sử dụng axit HBr
Việc sử dụng axit HBr cần phải tuân thủ các quy tắc an toàn nghiêm ngặt để đảm bảo an toàn cho người sử dụng và môi trường. Dưới đây là một số lưu ý quan trọng khi làm việc với axit HBr:
-
An toàn lao động: HBr là một chất ăn mòn cao, có khả năng gây bỏng da và hại cho mắt. Do đó, người sử dụng cần phải sử dụng trong môi trường an toàn với đầy đủ thiết bị bảo hộ cá nhân như găng tay, kính bảo hộ và áo khoác chống hóa chất.
-
Quy trình thao tác: Nên lấy axit HBr trong tủ an toàn sinh học có quạt thông gió. Nếu axit dính vào da, cần rửa ngay bằng nước sạch và tìm kiếm sự trợ giúp y tế nếu cần thiết.
-
Lưu trữ: Axit HBr cần được lưu trữ trong các bình chứa được làm từ vật liệu chống ăn mòn, có nắp kín để tránh bay hơi và tiếp xúc với không khí.
Các biện pháp an toàn này không chỉ giúp bảo vệ bản thân mà còn góp phần bảo vệ môi trường, hạn chế rủi ro trong quá trình sử dụng axit HBr.
So sánh axit HBr với các axit khác
Axit HBr không chỉ có những đặc điểm riêng mà còn có thể so sánh với các axit khác trong cùng nhóm halogenhidric như HCl, HI và HF. So sánh này giúp chúng ta hiểu rõ hơn về tính chất và vai trò của HBr trong hóa học.
Axit HBr mạnh hơn HCl
HBr với HCl
-
Tính axit: Trong bảng xếp hạng độ mạnh của axit halogenhidric, thứ tự mạnh yếu là HI > HBr > HCl > HF. HBr mạnh hơn HCl nhưng yếu hơn HI. Nguyên nhân chính là do liên kết giữa nguyên tử hidro và brom yếu hơn so với liên kết giữa hydro và clo.
-
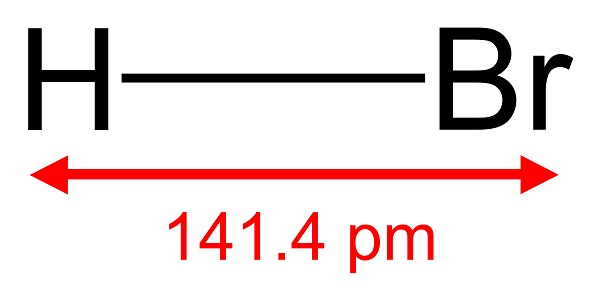
Cấu trúc hóa học: HBr là một phân tử diatomic, bao gồm một nguyên tử hydrogen và một nguyên tử brom, liên kết bằng liên kết cộng hóa trị đơn. Đối với HCl, cấu trúc tương tự nhưng nguyên tử clo thay thế cho brom.
-
Điểm sôi và nhiệt độ: HBr có điểm sôi khoảng 122°C trong khi HCl có điểm sôi khoảng -85°C, cho thấy HBr có nhiệt độ sôi cao hơn.
HBr với HI
-
Tính axit: HI là axit mạnh nhất trong nhóm axit halogenhidric. Độ phân ly H⁺ của HI cao nhất, tiếp theo là HBr, do vậy HI sẽ tạo ra nồng độ ion H⁺ cao hơn HBr.
-
Tác dụng với kim loại: Cả HBr và HI đều phản ứng mạnh mẽ với các kim loại, giải phóng khí hydrogen. HBr tạo ra muối bromide, trong khi HI tạo ra muối iodide.
-
Điều kiện điều chế: HBr được điều chế bằng hòa tan khí brom trong nước, trong khi HI thường sử dụng iod và hydro.
HBr với HF
-
Tính mạnh/nhược: HBr là axit mạnh, phân ly hoàn toàn trong nước; trong khi HF là axit yếu, không phân ly hoàn toàn, do sự hình thành liên kết hydro mạnh giữa các phân tử HF.
-
Tác động: HBr mạnh hơn trong việc làm thay đổi màu của chỉ thị pH và phản ứng với kim loại hơn nữa HF có thể gây ăn mòn nhưng không mạnh mẽ trong tính axit.
-
Bán kính nguyên tử: HBr có bán kính nguyên tử lớn hơn HF, dẫn đến độ yếu hơn của lực kết nối trong HF làm cho HF không mạnh như HBr.
Với những so sánh trên, có thể thấy rằng HBr và các axit halogenhidric khác đều mang theo những đặc điểm riêng biệt và quan trọng trong hóa học nhưng cũng có những điểm khác biệt không thể thể bỏ qua.
Axit bromhidric HBr là một hợp chất hóa học quan trọng trong ngành hóa học và công nghiệp, với nhiều ứng dụng đa dạng từ sản xuất thuốc đến quy trình khắc ăn mòn trong ngành điện tử. Tính chất mạnh mẽ của HBr không chỉ thể hiện qua khả năng phản ứng hóa học mà còn qua việc phân ly hoàn toàn trong dung dịch nước để tạo ra nồng độ ion H⁺ cao. Tuy nhiên, việc sử dụng HBr cần phải được thực hiện trong điều kiện an toàn, với những quy tắc nghiêm ngặt nhằm bảo vệ sức khỏe con người và môi trường. Thông qua bài viết này, dongachem.vn hy vọng bạn đã có thêm những kiến thức bổ ích về axit HBr là gì và những ứng dụng cùng nguy cơ khi làm việc với nó.