Số oxi hóa của oxy là một trong những khái niệm cơ bản nhưng vô cùng quan trọng trong hóa học. Nó không chỉ giúp chúng ta hiểu rõ hơn về các phản ứng hóa học mà còn là chiếc cầu nối giữa các kiến thức nền tảng và ứng dụng trong đời sống. Như những người bạn đồng hành trong một hành trình khám phá, số oxi hóa của oxy đồng hành cùng chúng ta qua từng giai đoạn của phản ứng hóa học, từ những phần tử đơn giản đến những hợp chất phức tạp. Trong bài viết này, hãy cùng Đông Á Chemical khám phá những khía cạnh thú vị và đa dạng của số oxi hóa của oxy, từ các quy tắc cơ bản đến các trường hợp đặc biệt.
Tìm hiểu số oxi hóa của oxi là bao nhiêu?
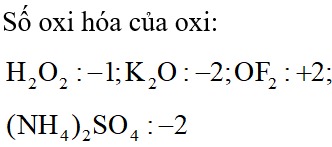
Tìm hiểu số oxi hóa của oxi là bao nhiêu?
Thông thường, số oxi hóa của oxi (O) trong các hợp chất là -2.
Tuy nhiên, có một số trường hợp ngoại lệ mà bạn cần lưu ý:
-
Trong peroxit: Oxi có số oxi hóa -1 (ví dụ: H₂O₂).
-
Trong hợp chất với flo (F₂O): Oxi có số oxi hóa +2 (do flo có độ âm điện lớn nhất, luôn có số oxi hóa -1 trong các hợp chất).
Sở dĩ số oxi hóa của oxy là -2 vì điều này liên quan đến cấu hình electron của nguyên tử oxi. Để đạt được cấu hình bền vững của khí hiếm gần nhất, oxi thường nhận thêm 2 electron, do đó mang điện tích âm và có số oxi hóa là -2.
Các quy tắc xác định số oxi hóa của oxy
Số oxi hóa của oxy là một khái niệm quan trọng trong hóa học, giúp chúng ta hiểu rõ hơn về tính chất của các hợp chất chứa oxi. Dưới đây là các quy tắc chung để xác định số oxi hóa của oxi:
Quy tắc chung:
Trường hợp ngoại lệ:
-
Trong peroxit: Oxi có số oxi hóa -1 (ví dụ: H₂O₂, Na₂O₂).
-
Trong hợp chất với flo (F₂O): Oxi có số oxi hóa +2 (do flo có độ âm điện lớn nhất, luôn có số oxi hóa -1 trong các hợp chất).
Giải thích:
-
Số oxi hóa -2: Cấu hình electron của nguyên tử oxi cho thấy nó cần thêm 2 electron để đạt được cấu hình bền vững của khí hiếm gần nhất. Do đó, trong hầu hết các hợp chất, oxi sẽ nhận thêm 2 electron và mang điện tích âm, có số oxi hóa là -2.
-
Ngoại lệ:
-
Peroxit: Trong peroxit, liên kết O-O là liên kết đơn và mỗi nguyên tử oxi chỉ nhận thêm 1 electron, nên số oxi hóa là -1.
-
F₂O: Flo có độ âm điện lớn hơn oxi, nên khi kết hợp với oxi, flo sẽ kéo electron về phía mình mạnh hơn, khiến oxi mang điện tích dương và có số oxi hóa +2.
Ví dụ về số oxi hóa của oxy trong các hợp chất
Để rõ hơn về số oxi hóa của oxy trong các hợp chất, chúng ta hãy điểm qua một số ví dụ tiêu biểu vể số oxi hóa khác nhau mà oxy có thể thể hiện.
1. Số oxi hóa của oxi trong H₂O
-
Kết quả: Mỗi nguyên tử O có số oxi hóa -2.
-
Giải thích: Đây là trường hợp điển hình, oxi tuân theo quy tắc chung, có số oxi hóa là -2. Hidro thường có số oxi hóa +1 trong các hợp chất với phi kim. Để phân tử H₂O trung hòa về điện tích, mỗi nguyên tử O phải có số oxi hóa -2.
2. Số oxi hóa của oxi trong H₂O₂
-
Kết quả: Mỗi nguyên tử O có số oxi hóa -1.
-
Giải thích: Đây là trường hợp ngoại lệ, H₂O₂ là một peroxide. Trong peroxide, liên kết O-O là liên kết đơn và mỗi nguyên tử oxi chỉ nhận thêm 1 electron, nên số oxi hóa là -1.
3. Số oxi hóa của oxi trong OF₂
-
Kết quả: Nguyên tử O có số oxi hóa +2.
-
Giải thích: Đây là một trường hợp ngoại lệ khác. Flo là nguyên tố có độ âm điện lớn nhất, luôn có số oxi hóa -1 trong các hợp chất. Để phân tử OF₂ trung hòa về điện tích, nguyên tử O phải có số oxi hóa +2.
Lưu ý:
-
Số oxi hóa của oxi có thể thay đổi tùy thuộc vào loại hợp chất và các nguyên tố liên kết với nó.
-
Việc xác định số oxi hóa giúp chúng ta hiểu rõ hơn về bản chất của các liên kết hóa học và các phản ứng hóa học.
Các ứng dụng của số oxi hóa của oxy trong hóa học
Số oxi hóa của oxy là một khái niệm quan trọng trong hóa học, nó giúp chúng ta hiểu rõ hơn về tính chất của các hợp chất chứa oxy và dự đoán các phản ứng hóa học. Dưới đây là một số ứng dụng cụ thể:

1. Xác định tính chất hóa học của hợp chất:
-
Tính oxi hóa - khử: Số oxi hóa của oxy cho biết khả năng nhận hoặc nhường electron của nguyên tử oxi trong hợp chất. Ví dụ, trong các peroxit (như H₂O₂), oxy có số oxi hóa -1, thể hiện khả năng vừa oxi hóa vừa khử.
-
Tính bền vững của hợp chất: Số oxi hóa giúp dự đoán sự bền vững của một hợp chất. Các hợp chất có chứa oxy ở các số oxi hóa cao thường kém bền hơn so với các hợp chất có số oxi hóa thấp.
2. Cân bằng phương trình phản ứng:
-
Xác định chất khử và chất oxi hóa: Số oxi hóa giúp xác định nguyên tử nào bị oxi hóa và nguyên tử nào bị khử trong một phản ứng hóa học.
-
Viết các quá trình bán phản ứng: Từ đó, ta có thể viết các quá trình bán phản ứng oxi hóa và khử, sau đó cân bằng phương trình phản ứng.
3. Dự đoán sản phẩm phản ứng:
-
Dựa vào số oxi hóa: Biết số oxi hóa của oxy trong các chất phản ứng, ta có thể dự đoán được sản phẩm tạo thành sau phản ứng.
-
Áp dụng các quy tắc bảo toàn điện tích: Số oxi hóa giúp ta kiểm tra lại kết quả và đảm bảo phương trình hóa học được cân bằng.
4. Ứng dụng trong công nghiệp:
-
Sản xuất hóa chất: Số oxi hóa của oxy giúp các nhà khoa học và kỹ sư lựa chọn các điều kiện phản ứng phù hợp để sản xuất các hóa chất có chứa oxy.
-
Xử lý nước: Trong quá trình xử lý nước, số oxi hóa của oxy giúp xác định lượng oxy cần thiết để khử trùng nước một cách hiệu quả.
-
Sản xuất giấy: Oxy được sử dụng để tẩy trắng bột gỗ trong quá trình sản xuất giấy.
-
Sản xuất thuốc trừ sâu: Nhiều loại thuốc trừ sâu chứa các hợp chất hữu cơ oxy. Số oxi hóa của oxy trong các hợp chất này ảnh hưởng đến tính độc và hiệu quả của thuốc trừ sâu.
5. Nghiên cứu khoa học:
-
Nghiên cứu cấu trúc phân tử: Số oxi hóa giúp các nhà khoa học hiểu rõ hơn về cấu trúc của các phân tử chứa oxy.
-
Nghiên cứu cơ chế phản ứng: Số oxi hóa giúp giải thích cơ chế của các phản ứng hóa học liên quan đến oxy.
Những vấn đề thường gặp khi xác định số oxi hóa của oxy
Mặc dù số oxi hóa của oxy thường là -2, nhưng việc xác định số oxi hóa của nguyên tố này trong một số hợp chất phức tạp có thể gây ra một số khó khăn. Dưới đây là những vấn đề thường gặp:
1. Các hợp chất peroxide:
-
Đặc điểm: Trong các peroxide, liên kết O-O là liên kết đơn và mỗi nguyên tử oxi chỉ nhận thêm 1 electron.
-
Vấn đề: Học sinh thường nhầm lẫn với quy tắc chung và gán cho oxi số oxi hóa -2.
-
Ví dụ: H₂O₂, Na₂O₂
2. Hợp chất với flo:
-
Đặc điểm: Flo là nguyên tố có độ âm điện lớn nhất, luôn có số oxi hóa -1 trong các hợp chất.
-
Vấn đề: Học sinh có thể khó hình dung trường hợp oxi lại mang điện tích dương.
-
Ví dụ: OF₂
3. Hợp chất phức tạp:
-
Đặc điểm: Trong các hợp chất phức tạp, đặc biệt là các hợp chất hữu cơ, việc xác định số oxi hóa của từng nguyên tử oxi có thể trở nên phức tạp.
-
Vấn đề: Cần phải xem xét đến các liên kết cộng hóa trị phân cực và các quy tắc ưu tiên trong việc gán số oxi hóa.
4. Nhầm lẫn với điện tích:
-
Vấn đề: Một số học sinh nhầm lẫn giữa số oxi hóa và điện tích thực tế của nguyên tử trong phân tử.
-
Giải thích: Số oxi hóa là một số đại số gán cho nguyên tử trong một phân tử, nó không phải là điện tích thực tế của nguyên tử đó.
5. Thiếu hệ thống trong việc áp dụng các quy tắc:
Với những thông tin được Đông Á Chemical chia sẻ trên có thể thấy từ những hợp chất đơn giản như H₂O cho đến những hợp chất phức tạp như O₂ và H₂O₂, số oxi hóa của oxy luôn có những biến hóa đáng kinh ngạc. Hiểu rõ số oxi hóa không chỉ giúp chúng ta nhận diện bản chất hóa học mà còn mở ra cánh cửa đến những lĩnh vực nghiên cứu mới mẻ, từ sinh học, môi trường cho đến phát triển công nghệ. Chính vì vậy, khái niệm này thật sự là viên ngọc quý trong kho tàng kiến thức hóa học mà mỗi người học đều cần khám phá và trau dồi.