Trong thế giới hóa học, số oxi hóa của các nguyên tố là một khái niệm vô cùng quan trọng. Clo, với ký hiệu hóa học Cl, không phải là một ngoại lệ. Từ lâu, nguyên tố này đã gây ấn tượng sâu sắc trong các ứng dụng hóa học nhờ vào khả năng thay đổi số oxi hóa của clo trong các hợp chất khác nhau. Nhìn từ cái nhìn tổng quát, sự biến thiên này không chỉ phản ánh tính linh hoạt trong hóa học mà còn mở ra nhiều cánh cửa cho những nghiên cứu và ứng dụng thực tiễn. Trong bài viết này hãy cùng Đông Á Chemical tìm hiểu chi tiết về số oxi hóa của clo các bạn nhé!
Các số oxi hóa phổ biến của clo
Clo (Cl) là một nguyên tố hóa học thuộc nhóm halogen, có tính oxi hóa mạnh và có khả năng thể hiện nhiều số oxi hóa khác nhau trong các hợp chất.

Clo có nhiều số oxi hóa khác nhau
Các số oxi hóa phổ biến của Clo là:
-
-1: Đây là số oxi hóa phổ biến nhất của clo trong các hợp chất như HCl (axit clohiđric), NaCl (natri clorua).
-
0: Trong phân tử clo (Cl₂), mỗi nguyên tử clo có số oxi hóa bằng 0.
-
+1: Trong các hợp chất như NaClO (natri hipoclorit), HClO (axit hipoclorơ).
-
+3: Trong các hợp chất như NaClO₂ (natri clorit), HClO₂ (axit clorơ).
-
+5: Trong các hợp chất như NaClO₃ (natri clorat), HClO₃ (axit cloric).
-
+7: Trong các hợp chất như NaClO₄ (natri peclorat), HClO₄ (axit pecloric).
Lưu ý:
-
Số oxi hóa: Là điện tích của nguyên tử trong phân tử, giả định rằng tất cả các liên kết đều là ion.
-
Sự thay đổi số oxi hóa: Số oxi hóa của clo có thể thay đổi từ -1 đến +7 tùy thuộc vào bản chất của các nguyên tử liên kết với nó và điều kiện của phản ứng.
-
Tính chất hóa học: Sự thay đổi số oxi hóa của clo ảnh hưởng đến tính chất hóa học của hợp chất. Ví dụ, các hợp chất clo có số oxi hóa dương thường có tính oxi hóa mạnh hơn so với các hợp chất có số oxi hóa âm.
Ví dụ về sự thay đổi số oxi hóa của clo trong các phản ứng:
Phản ứng giữa clo và natri hidroxit:
Cl₂ + 2NaOH → NaCl + NaClO + H₂O
Trong phản ứng này, clo vừa đóng vai trò chất oxi hóa (số oxi hóa giảm từ 0 xuống -1), vừa đóng vai trò chất khử (số oxi hóa tăng từ 0 lên +1).
Quy tắc xác định số oxi hóa của clo
Số oxi hóa của một nguyên tố trong một hợp chất là điện tích mà nguyên tử của nguyên tố đó mang nếu tất cả các liên kết trong hợp chất đó là liên kết ion.
Clo (Cl) là một nguyên tố phi kim hoạt động hóa học mạnh, có thể thể hiện nhiều số oxi hóa khác nhau trong các hợp chất. Để xác định số oxi hóa của clo trong một hợp chất cụ thể, chúng ta có thể áp dụng các quy tắc sau:
Các quy tắc cơ bản
-
Trong đơn chất: Số oxi hóa của nguyên tố bằng 0. Ví dụ: Cl₂ (clo phân tử), số oxi hóa của Cl là 0.
-
Trong ion đơn nguyên tử: Số oxi hóa của nguyên tố bằng điện tích của ion. Ví dụ: Cl⁻ (ion clorua), số oxi hóa của Cl là -1.
-
Trong hợp chất:
-
Tổng số oxi hóa của các nguyên tử trong một phân tử bằng 0.
-
Trong hầu hết các hợp chất, số oxi hóa của H là +1 (trừ trong các hidrua kim loại như NaH, CaH₂...), O là -2 (trừ trong các peroxit như H₂O₂).
Ví dụ minh họa
-
HCl:
-
NaClO:
-
Na có số oxi hóa +1, O có số oxi hóa -2
-
Tổng số oxi hóa của phân tử bằng 0 → Số oxi hóa của Cl là +1.
-
HClO₃:
Các giá trị số oxi hóa của clo trong các hợp chất phổ biến
Clo (Cl) là một nguyên tố hóa học thuộc nhóm halogen, có khả năng thể hiện nhiều số oxi hóa khác nhau trong các hợp chất. Các số oxi hóa phổ biến của Clo trong các hợp chất phổ biến như sau:
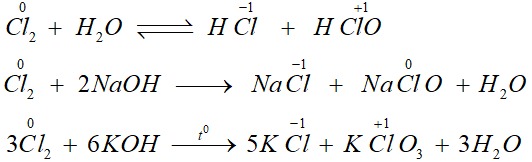
Các giá trị số oxi hóa của clo trong các hợp chất phổ biến
-
-1: Đây là số oxi hóa phổ biến nhất, thường gặp trong các hợp chất như:
-
HCl (axit clohiđric)
-
NaCl (natri clorua)
-
Các muối clorua khác
-
0: Trong phân tử clo tự do (Cl₂), mỗi nguyên tử clo có số oxi hóa bằng 0.
-
+1: Trong các hợp chất như:
-
+3: Trong các hợp chất như:
-
NaClO₂ (natri clorit)
-
HClO₂ (axit clorơ)
-
+5: Trong các hợp chất như:
-
NaClO₃ (natri clorat)
-
HClO₃ (axit cloric)
-
+7: Trong các hợp chất như:
-
NaClO₄ (natri peclorat)
-
HClO₄ (axit pecloric)
Tầm quan trọng của số oxi hóa clo trong hóa học
Số oxi hóa của clo đóng vai trò vô cùng quan trọng trong việc hiểu và dự đoán tính chất hóa học của các hợp chất chứa clo. Nó giúp chúng ta:
Tầm quan trọng của số oxi hóa clo trong hóa học
1. Xác định tính chất hóa học của hợp chất:
-
Tính oxi hóa - khử: Số oxi hóa của clo cho biết khả năng nhận hoặc nhường electron của nguyên tử clo trong hợp chất. Clo có thể thể hiện cả tính oxi hóa (khi nhận electron) và tính khử (khi nhường electron) tùy thuộc vào số oxi hóa của nó.
-
Tính bền vững của hợp chất: Các hợp chất có chứa clo ở các số oxi hóa khác nhau sẽ có độ bền khác nhau. Ví dụ, các hợp chất clo có số oxi hóa cao thường kém bền hơn so với các hợp chất có số oxi hóa thấp.
2. Cân bằng phương trình phản ứng:
-
Xác định chất khử và chất oxi hóa: Số oxi hóa giúp xác định nguyên tử nào bị oxi hóa và nguyên tử nào bị khử trong một phản ứng hóa học.
-
Viết các quá trình bán phản ứng: Từ đó, ta có thể viết các quá trình bán phản ứng oxi hóa và khử, sau đó cân bằng phương trình phản ứng.
3. Dự đoán sản phẩm phản ứng:
-
Dựa vào số oxi hóa: Biết số oxi hóa của clo trong các chất phản ứng, ta có thể dự đoán được sản phẩm tạo thành sau phản ứng.
-
Áp dụng các quy tắc bảo toàn điện tích: Số oxi hóa giúp ta kiểm tra lại kết quả và đảm bảo phương trình hóa học được cân bằng.
4. Ứng dụng trong công nghiệp:
-
Sản xuất hóa chất: Số oxi hóa của clo giúp các nhà khoa học và kỹ sư lựa chọn các điều kiện phản ứng phù hợp để sản xuất các hóa chất có chứa clo.
-
Xử lý nước: Trong quá trình xử lý nước, số oxi hóa của clo giúp xác định lượng clo cần thiết để khử trùng nước một cách hiệu quả.
5. Nghiên cứu khoa học:
-
Nghiên cứu cấu trúc phân tử: Số oxi hóa giúp các nhà khoa học hiểu rõ hơn về cấu trúc của các phân tử chứa clo.
-
Nghiên cứu cơ chế phản ứng: Số oxi hóa giúp giải thích cơ chế của các phản ứng hóa học liên quan đến clo.
Có thể hiểu, số oxi hóa của clo là một công cụ hữu ích giúp chúng ta hiểu rõ hơn về tính chất hóa học, phản ứng hóa học và các ứng dụng của clo trong đời sống và sản xuất.
Hy vọng rằng qua bài viết trên của Đông Á Chemical các bạn đã nắm được số oxi hóa của clo .Việc hiểu rõ số oxi hóa không chỉ giúp cho các nhà khoa học trong việc dự đoán các phản ứng hóa học mà còn mở rộng khả năng ứng dụng của nó trong thực tiễn, từ sản xuất công nghiệp cho đến nghiên cứu và phát triển trong lĩnh vực thuốc và dược phẩm. Các nghiên cứu và ứng dụng liên quan đến số oxi hóa của clo không chỉ dừng lại ở một phạm vi hẹp mà còn có thể mở rộng ra nhiều lĩnh vực khác, tạo ra những giá trị mới cho xã hội.