Phản ứng este hóa, một trong những quy trình hóa học cơ bản nhưng phải tạo ra những sản phẩm vô cùng đa dạng, có mặt trong rất nhiều lĩnh vực của đời sống con người. Hãy hình dung một thế giới có mùi hương ngọt ngào của nước hoa hay có hương vị thơm ngon từ các món ăn yêu thích. Thực tế là, tất cả những điều đó đều nhờ vào phản ứng este hóa - một quá trình không chỉ quan trọng trong hóa học hữu cơ mà còn có một vị trí không thể thay thế trong công nghiệp chế biến thực phẩm, sản xuất mỹ phẩm và dược phẩm. Bài viết này sẽ đưa bạn vào hành trình khám phá phản ứng este hóa là gì, từ định nghĩa đến các ứng dụng thiết thực trong cuộc số
Định nghĩa phản ứng este hóa là gì?
Phản ứng este hóa là một phản ứng hữu cơ trong đó một axit cacboxylic tác dụng với một ancol để tạo thành một este và nước. Đây là một phản ứng thuận nghịch và thường được xúc tác bởi axit vô cơ mạnh như axit sulfuric (H₂SO₄).
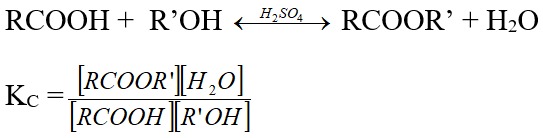
Minh họa phương trình tổng quát của phản ứng este hóa
Cơ chế Phản Ứng
Cơ chế phản ứng este hóa thường được mô tả qua các bước sau:
-
Proton hóa nhóm carbonyl: Nguyên tử oxi trong nhóm carbonyl của axit cacboxylic được proton hóa bởi axit xúc tác, làm tăng tính điện dương của nguyên tử cacbon carbonyl.
-
Tấn công nucleophin: Nguyên tử oxi của nhóm hydroxyl trong ancol tấn công vào nguyên tử cacbon carbonyl, tạo thành một cấu trúc trung gian tetrahedral.
-
Loại nước: Một phân tử nước bị loại bỏ, tạo thành liên kết giữa nguyên tử cacbon carbonyl và nguyên tử oxi của ancol, tạo ra este.
-
Mất proton: Proton được chuyển từ một phân tử nước khác đến nhóm OH để tạo thành một phân tử nước mới và tái sinh xúc tác axit.
Các Yếu Tố Ảnh Hưởng đến Phản Ứng Este Hóa
-
Tính chất của axit cacboxylic và ancol: Axit cacboxylic càng mạnh và ancol càng đơn giản thì phản ứng càng dễ xảy ra.
-
Xúc tác: Axit vô cơ mạnh như H₂SO₄ là xúc tác phổ biến nhất. Việc lựa chọn loại axit và nồng độ axit cũng ảnh hưởng đến tốc độ phản ứng.
-
Nhiệt độ: Nâng cao nhiệt độ làm tăng tốc độ phản ứng.
-
Nồng độ chất tham gia: Tăng nồng độ chất tham gia làm tăng tốc độ phản ứng.
-
Hút nước: Việc loại bỏ nước sinh ra khỏi hệ phản ứng sẽ làm dịch chuyển cân bằng về phía sản phẩm, tăng hiệu suất phản ứng.
Điều Kiện Phản Ứng
-
Nhiệt độ: Thường được thực hiện ở nhiệt độ cao (khoảng 100-150°C).
-
Môi trường: Môi trường axit, thường sử dụng H₂SO₄ đậm đặc.
-
Xúc tác: Axit vô cơ mạnh như H₂SO₄.
Phương Trình Tổng Quát
RCOOH + R'OH ⇌ RCOOR' + H₂O
Trong đó:
-
RCOOH: Axit cacboxylic
-
R'OH: Ancol
-
RCOOR': Este
-
H₂O: Nước
Ví dụ
CH₃COOH + C₂H₅OH ⇌ CH₃COOC₂H₅ + H₂O
Hiệu suất của phản ứng este hóa là gì?
Hiệu suất của phản ứng este hóa là tỷ lệ phần trăm giữa lượng este thực tế thu được so với lượng este lý thuyết (tính toán theo phương trình phản ứng) trong một phản ứng este hóa.
Hiệu suất của phản ứng este hóa là đại lượng đánh giá hiệu quả phản ứng
Vì sao cần quan tâm đến hiệu suất phản ứng?
-
Đánh giá hiệu quả của phản ứng: Hiệu suất phản ứng cho biết phản ứng diễn ra đến đâu, từ đó đánh giá hiệu quả của quá trình sản xuất este.
-
Tối ưu hóa điều kiện phản ứng: Bằng cách đo hiệu suất, chúng ta có thể điều chỉnh các yếu tố như nhiệt độ, nồng độ, xúc tác để tăng hiệu suất phản ứng.
-
Tính toán lượng chất tham gia phản ứng: Hiệu suất phản ứng giúp ta tính toán chính xác lượng chất cần thiết để thu được một lượng este mong muốn.
Công thức tính hiệu suất phản ứng:
Hiệu suất (%) = (Lượng este thực tế thu được / Lượng este lý thuyết) x 100%
Các yếu tố ảnh hưởng đến hiệu suất phản ứng este hóa:
-
Tính chất của axit cacboxylic và ancol: Axit cacboxylic mạnh và ancol đơn giản thường cho hiệu suất cao hơn.
-
Xúc tác: Axit sunfuric đậm đặc là xúc tác phổ biến, nhưng các loại xúc tác khác cũng có thể được sử dụng.
-
Nhiệt độ: Nâng cao nhiệt độ thường làm tăng tốc độ phản ứng và hiệu suất.
-
Nồng độ chất tham gia: Tăng nồng độ chất tham gia có thể làm tăng hiệu suất.
-
Hút nước: Việc loại bỏ nước sinh ra khỏi hệ phản ứng sẽ làm dịch chuyển cân bằng về phía sản phẩm, tăng hiệu suất.
Các yếu tố làm giảm hiệu suất:
-
Phản ứng thuận nghịch: Phản ứng este hóa là một phản ứng thuận nghịch, nên một phần sản phẩm có thể chuyển hóa ngược trở lại thành chất ban đầu.
-
Phản ứng phụ: Có thể xảy ra các phản ứng phụ làm giảm lượng este thu được.
-
Mất mát trong quá trình thực hiện: Một phần este có thể bị mất trong quá trình tách chiết, tinh chế.
Cách tăng hiệu suất phản ứng este hóa:
-
Sử dụng dư một trong hai chất tham gia: Điều này giúp đẩy mạnh phản ứng về phía tạo thành este.
-
Loại bỏ nước sinh ra: Có thể sử dụng các chất hút ẩm như CaCl₂ hoặc các thiết bị chưng cất để loại bỏ nước.
-
Tăng nhiệt độ: Tuy nhiên, cần chú ý đến nhiệt độ sôi của các chất tham gia và sản phẩm.
-
Sử dụng xúc tác hiệu quả: Chọn loại xúc tác phù hợp và điều chỉnh nồng độ xúc tác.
Ứng dụng của phản ứng este hóa trong ngành công nghiệp
Phản ứng este hóa, với vai trò quan trọng trong tổng hợp hữu cơ, đóng góp đáng kể vào sự phát triển của nhiều ngành công nghiệp. Dưới đây là một số ứng dụng điển hình:
1. Ngành công nghiệp thực phẩm:

Ứng dụng tạo mùi trong thực phẩm
-
Chất tạo hương: Nhiều este có mùi thơm đặc trưng của hoa quả, vì vậy chúng được sử dụng rộng rãi làm chất tạo hương trong công nghiệp thực phẩm. Ví dụ: ethyl acetate có mùi chuối, butyl acetate có mùi chuối chín.
-
Dung môi: Một số este được sử dụng làm dung môi để chiết xuất các chất có mùi thơm từ tự nhiên, hoặc làm dung môi cho các chất màu thực phẩm.
2. Ngành công nghiệp mỹ phẩm:
-
Nước hoa: Nhiều este có mùi thơm hoa cỏ, trái cây được sử dụng để tạo ra các loại nước hoa.
-
Kem dưỡng da: Một số este có tác dụng làm mềm da, dưỡng ẩm và được sử dụng trong các sản phẩm chăm sóc da.
3. Ngành công nghiệp dược phẩm:
-
Tổng hợp dược phẩm: Nhiều dược phẩm có chứa nhóm este. Phản ứng este hóa được sử dụng để tổng hợp các hợp chất này.
-
Chất mang thuốc: Một số este được sử dụng làm chất mang thuốc, giúp tăng khả năng hấp thu của thuốc.
4. Ngành công nghiệp sơn:

Ứng dụng trong sản xuất sơn
-
Dung môi: Este được sử dụng làm dung môi cho sơn, giúp sơn dễ dàng bám dính lên bề mặt.
-
Chất tạo màng: Một số este có khả năng tạo màng, được sử dụng trong sản xuất sơn.
5. Ngành công nghiệp nhựa:
-
Chất dẻo: Nhiều loại nhựa được sản xuất từ các este của axit acrylic và methacrylic. Ví dụ: poly(methyl methacrylate) (PMMA) được sử dụng để sản xuất kính hữu cơ.
-
Chất hóa dẻo: Este của axit phthalic được sử dụng làm chất hóa dẻo cho nhựa PVC.
6. Ngành công nghiệp dệt:
7. Ngành công nghiệp sản xuất hóa chất:
Phân biệt phản ứng este hóa và phản ứng thủy phân este
Có một thực tế thú vị rằng, phản ứng este hóa và phản ứng thủy phân este thường có những điểm tương đồng và khác biệt khá rõ ràng. Trong khi một quá trình tạo ra sản phẩm quý thì quá trình kia lại ngược lại, chủ yếu tập trung vào việc phân hủy este. Dưới đây là bảng so sánh chi tiết:
|
Đặc điểm
|
Phản ứng este hóa
|
Phản ứng thủy phân este
|
|
Chất tham gia
|
Axit cacboxylic, ancol
|
Este, nước
|
|
Sản phẩm
|
Este, nước
|
Axit cacboxylic, ancol
|
|
Điều kiện
|
Môi trường axit, nhiệt độ cao
|
Môi trường axit hoặc kiềm
|
|
Tính chất
|
Thuận nghịch
|
Thuận nghịch
|
|
Ứng dụng
|
Tổng hợp este
|
Sản xuất xà phòng, điều chế các hợp chất hữu cơ khác
|
Phản ứng este hóa và phản ứng thủy phân este là hai phản ứng ngược chiều nhau, cùng liên quan đến việc hình thành và phá vỡ liên kết este. Việc hiểu rõ cơ chế và điều kiện của hai phản ứng này rất quan trọng trong việc nghiên cứu và ứng dụng các hợp chất hữu cơ chứa nhóm este.
Ví dụ minh họa về phản ứng este hóa
Phản ứng este hóa là một phản ứng hữu cơ quan trọng, trong đó một axit cacboxylic tác dụng với một ancol để tạo thành một este và nước. Phản ứng này thường được xúc tác bởi axit vô cơ mạnh như axit sulfuric (H₂SO₄).
Ví dụ điển hình: Tạo thành ethyl axetat
Một trong những ví dụ đơn giản và phổ biến nhất của phản ứng este hóa là phản ứng giữa axit axetic (CH₃COOH) và ethanol (C₂H₅OH) để tạo thành ethyl axetat (CH₃COOC₂H₅) và nước.
Phương trình phản ứng:
CH₃COOH + C₂H₅OH ⇌ CH₃COOC₂H₅ + H₂O
Ví dụ khác: Tạo thành methyl salicylate
Methyl salicylate là một este có mùi dầu gió, được sử dụng rộng rãi trong y học và mỹ phẩm. Nó được tạo thành từ phản ứng giữa axit salicylic và methanol.
Phương trình phản ứng:
C₆H₄(OH)COOH + CH₃OH ⇌ C₆H₄(OH)COOCH₃ + H₂O
Những sai lầm thường gặp trong phản ứng este hóa
Phản ứng este hóa là một phản ứng hữu cơ quan trọng, tuy nhiên trong quá trình thực hiện, chúng ta thường mắc phải một số sai lầm. Dưới đây là những sai lầm phổ biến và cách khắc phục:
Những sai lầm thường gặp trong phản ứng este hóa
1. Không chọn đúng xúc tác:
-
Sai lầm: Sử dụng sai loại xúc tác hoặc nồng độ xúc tác không phù hợp.
-
Hậu quả: Phản ứng xảy ra chậm, hiệu suất thấp hoặc không xảy ra.
-
Khắc phục:
-
Chọn đúng loại xúc tác: Thông thường, axit sunfuric đậm đặc (H₂SO₄) được sử dụng. Tuy nhiên, tùy thuộc vào loại axit cacboxylic và ancol, có thể sử dụng các loại xúc tác khác như axit clohydric (HCl), axit photphoric (H₃PO₄).
-
Điều chỉnh nồng độ xúc tác: Nồng độ xúc tác quá thấp sẽ làm giảm tốc độ phản ứng, quá cao có thể gây ra các phản ứng phụ không mong muốn.
2. Điều kiện phản ứng không phù hợp:
-
Sai lầm: Nhiệt độ quá thấp hoặc quá cao, môi trường không đủ axit.
-
Hậu quả: Phản ứng xảy ra chậm, hiệu suất thấp hoặc không xảy ra.
-
Khắc phục:
3. Không loại bỏ nước sinh ra:
-
Sai lầm: Không có biện pháp loại bỏ nước sinh ra trong quá trình phản ứng.
-
Hậu quả: Phản ứng thuận nghịch, nước sinh ra sẽ làm giảm hiệu suất phản ứng.
-
Khắc phục:
-
Sử dụng chất hút ẩm: Sử dụng các chất hút ẩm như CaCl₂, H₂SO₄ đậm đặc để loại bỏ nước.
-
Chưng cất: Chưng cất để tách este ra khỏi hỗn hợp phản ứng.
4. Không tinh chế sản phẩm:
-
Sai lầm: Không tiến hành tinh chế sản phẩm sau phản ứng.
-
Hậu quả: Sản phẩm thu được không tinh khiết, ảnh hưởng đến chất lượng và ứng dụng.
-
Khắc phục:
-
Rửa sản phẩm: Rửa sản phẩm bằng nước để loại bỏ các tạp chất.
-
Chưng cất: Chưng cất để tách tinh khiết sản phẩm.
-
Kết tinh: Đối với các sản phẩm rắn, có thể sử dụng phương pháp kết tinh để tinh chế.
5. Không tính toán lượng chất tham gia chính xác:
-
Sai lầm: Tính toán sai lượng chất tham gia, dẫn đến một chất dư thừa, chất còn lại.
-
Hậu quả: Giảm hiệu suất phản ứng, lãng phí nguyên liệu.
-
Khắc phục:
6. Không chú ý đến tính chất của các chất tham gia:
-
Sai lầm: Không xem xét tính chất hóa học, vật lý của các chất tham gia.
-
Hậu quả: Có thể xảy ra các phản ứng phụ không mong muốn, làm giảm hiệu suất phản ứng.
-
Khắc phục:
Lưu ý: Để đạt được hiệu suất cao trong phản ứng este hóa, cần kết hợp nhiều yếu tố như: chọn đúng xúc tác, điều chỉnh nhiệt độ, loại bỏ nước, tinh chế sản phẩm và tính toán chính xác lượng chất tham gia.
Phản ứng este hóa không chỉ đơn thuần là một quá trình hóa học mà còn ẩn chứa rất nhiều điều thú vị và giá trị trong thực tiễn. Từ việc tìm hiểu về cơ chế phản ứng cho đến các yếu tố ảnh hưởng, điều kiện tối ưu, ứng dụng trong công nghiệp, chúng ta có thể thấy được sự phong phú và đa dạng của thế giới hóa học. Sự kết hợp giữa axit và ancol chính là một yếu tố quan trọng tạo nên những sản phẩm quý giá và cần thiết trong đời sống hàng ngày của con người. Dongachem.vn hi vọng rằng những hiểu biết về phản ứng este hóa là gì sẽ không chỉ giúp chúng ta trong việc nghiên cứu và thực nghiệm mà còn mở ra cơ hội cho việc phát triển những sản phẩm mới, chất lượng cao, phục vụ cho nhu cầu ngày càng đa dạng của xã hội.