Đặc điểm của oxit lưỡng tính
Để hiểu rõ oxit lưỡng tính, trước hết chúng ta hãy đi vào những đặc điểm nổi bật của chúng.

Đặc điểm của oxit lưỡng tính
Khả năng phản ứng với cả axit và bazơ chính là nét đặc trưng đầu tiên. Điều này giúp cho các oxit lưỡng tính đóng vai trò quan trọng trong nhiều phản ứng hóa học khác nhau. Ví dụ, oxit nhôm (Al₂O₃) có thể phản ứng với axit hydrochloric (HCl) và bazơ natri hydroxit (NaOH), lần lượt tạo thành muối và nước. Điều này tương tự như việc một nghệ sĩ đa tài có thể diễn xuất trong nhiều vai khác nhau, phù hợp với từng bối cảnh cụ thể.
Bên cạnh đó, tính chất hóa học của oxit lưỡng tính thường liên quan đến các kim loại có nhiều trạng thái oxy hóa. Điều này cho phép chúng thể hiện tính lưỡng tính một cách linh hoạt. Tính chất vật lý của các oxit lưỡng tính cũng đáng chú ý, với nhiều mẫu vật liệu có cấu trúc tinh thể, tăng cường khả năng dẫn điện và nhiệt. Hơn nữa, nhiều loại oxit này được sử dụng trong các ứng dụng công nghiệp như sản xuất gốm sứ và chất xúc tác hóa học, nhờ vào tính linh hoạt và khả năng đáp ứng tốt với nhiều yếu tố khác nhau trong môi trường hóa học.
|
Đặc điểm
|
Miêu tả
|
|
Khả năng phản ứng
|
Phản ứng với cả axit và bazơ, tạo ra muối và nước.
|
|
Tính chất hóa học
|
Thường liên quan đến các kim loại có nhiều trạng thái oxy hóa.
|
|
Tính chất vật lý
|
Nhiều oxit có cấu trúc tinh thể, khả năng dẫn điện và nhiệt tốt.
|
|
Ứng dụng
|
Sử dụng trong sản xuất gốm sứ, chất xúc tác hóa học, công nghiệp.
|
Giải thích về tính lưỡng tính của các oxit lưỡng tính
-
Cấu trúc điện tử: Nguyên tử trung tâm của oxit lưỡng tính thường có nhiều mức oxi hóa, cho phép chúng thể hiện cả tính chất cho và nhận electron.
-
Tính chất của hydroxide tương ứng: Hydroxide tương ứng của oxit lưỡng tính cũng có tính chất lưỡng tính. Ví dụ, Al(OH)₃ có thể vừa là axit, vừa là bazơ.
Các loại oxit lưỡng tính
Khi nói đến oxit lưỡng tính, chắc chắn không thể không nhắc đến bốn loại chính mà chúng ta thường gặp. Mỗi loại có đặc điểm và ứng dụng riêng, sự khác biệt này khiến cho mỗi loại oxit lưỡng tính đóng vai trò riêng biệt trong khoa học và công nghiệp.
Oxit Nhôm (Al₂O₃):
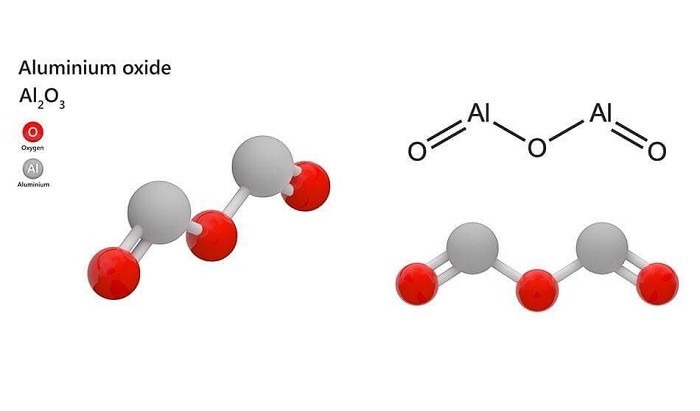
Oxit Nhôm (Al₂O₃)
Là một trong những oxit lưỡng tính phổ biến nhất, oxit nhôm không chỉ được sử dụng trong ngành gốm sứ mà còn trong nhiều ứng dụng công nghiệp khác.
Với axit: Al₂O₃ + 6HCl → 2AlCl₃ + 3H₂O
Với bazơ: Al₂O₃ + 2NaOH + 3H₂O → 2Na[Al(OH)₄] (natri aluminat)
Oxit Kẽm (ZnO):
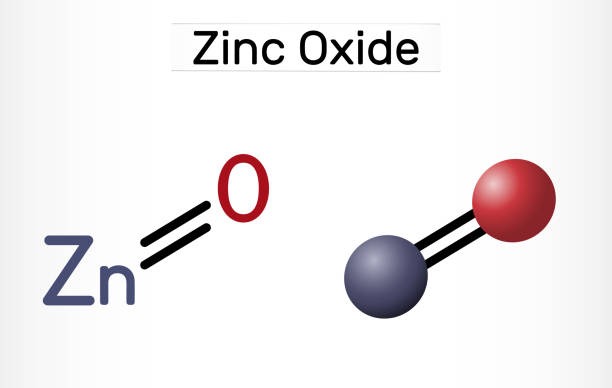
Oxit Kẽm (ZnO)
Kẽm oxit có vai trò quan trọng trong y tế, là thành phần trong kem chống nắng và nhiều sản phẩm chăm sóc da.
Với axit: ZnO + 2HCl → ZnCl₂ + H₂O
Với bazơ: ZnO + 2NaOH + H₂O → Na₂[Zn(OH)₄] (natri zincat)
Oxit Crom (Cr₂O₃):
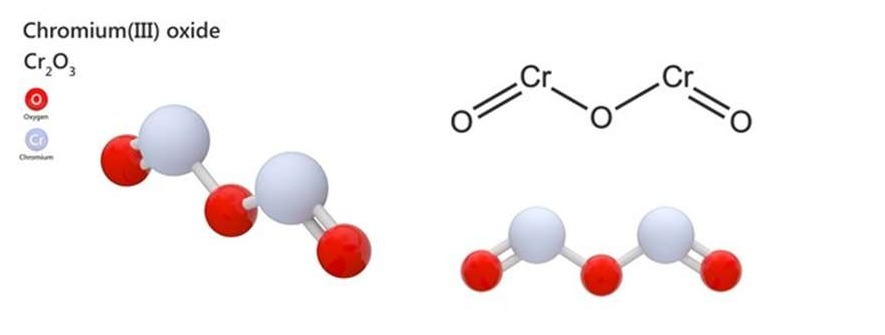
Oxit Crom (Cr₂O₃)
Oxit crom thường được sử dụng trong sản xuất vật liệu chịu nhiệt và làm chất xúc tác cho các phản ứng hóa học.
Cr2O3 + NaOH (đặc nóng) → NaCrO2 + H2O
Cr2O3 + 6HCl (đặc nóng) → 2CrCl3 + 3H2O
Oxit Thiếc (SnO):
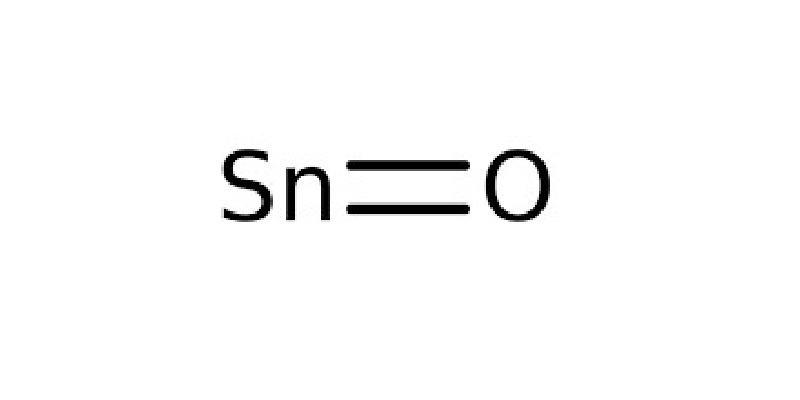
Oxit Thiếc (SnO)
Oxit thiếc có ứng dụng trong công nghiệp chế biến thực phẩm, sản xuất đồ gia dụng.
Phản ứng với axit: [ SnO + 2HCl → SnCl₂ + H₂O ]
Phản ứng với bazơ: [ SnO + 2NaOH → Na₂SnO₂ + H₂O ]
Bảng dưới đây tóm lược cách mà từng loại oxit lưỡng tính phản ứng với axit và bazơ:
|
Tên oxit
|
Phản ứng với axit
|
Phản ứng với bazơ
|
|
Oxit Nhôm (Al₂O₃)
|
Al₂O₃ + 6HCl → 2AlCl₃ + 3H₂O
|
Al₂O₃ + 2NaOH + 3H₂O → 2NaAl(OH)₄
|
|
Oxit Kẽm (ZnO)
|
ZnO + 2HCl → ZnCl₂ + H₂O
|
ZnO + 2NaOH → Na₂ZnO₂ + H₂O
|
|
Oxit Crom (Cr₂O₃)
|
Cr₂O₃ + 6HCl → 2CrCl₃ + 3H₂O
|
Cr₂O₃ + 2NaOH + 3H₂O → 2NaCr(OH)₆
|
|
Oxit Thiếc (SnO)
|
SnO + 2HCl → SnCl₂ + H₂O
|
SnO + 2NaOH → Na₂SnO₂ + H₂O
|
Ứng dụng của oxit lưỡng tính
Oxit lưỡng tính không chỉ tồn tại trong phòng thí nghiệm hay trang sách nghiên cứu mà còn có mặt rất nhiều trong cuộc sống hàng ngày và trong nhiều ứng dụng công nghiệp khác nhau. Hãy cùng khám phá những lĩnh vực mà oxit lưỡng tính đóng vai trò quan trọng.
Ngành công nghiệp gốm sứ:
Oxit nhôm (Al₂O₃) được sử dụng rất nhiều trong sản xuất gốm sứ và vật liệu chịu nhiệt. Chúng giúp tăng cường độ bền và khả năng chịu nhiệt cho các sản phẩm gốm.
Ngành sản xuất pin:
Oxit chì (PbO) đóng vai trò quan trọng trong sản xuất pin axit-chì, một nguồn năng lượng rất phổ biến trong xe cơ giới và hệ thống lưu trữ năng lượng.
Ngành mỹ phẩm:
Oxit kẽm (ZnO) được sử dụng trong nhiều sản phẩm chăm sóc da như kem chống nắng và kem trị mụn nhờ vào tính kháng khuẩn và khả năng bảo vệ da của nó.
Ngành sản xuất mực in và sơn:
Một số oxit lưỡng tính như PbO được sử dụng trong sản xuất mực in và sơn nhờ vào đặc tính bền màu, ổn định hóa học và khả năng chống ăn mòn.
Làm chất xúc tác:
Oxit lưỡng tính như Al₂O₃ thường được sử dụng làm chất xúc tác trong các phản ứng hóa học, giúp tăng tốc độ và hiệu quả của các phản ứng này.
Ngành nông nghiệp:
Một số oxit lưỡng tính có thể được sử dụng trong phân bón để cung cấp các yếu tố vi lượng cần thiết cho cây trồng, từ đó ảnh hưởng đến năng suất và chất lượng nông sản.
Khác biệt giữa oxit lưỡng tính và oxit axit, oxit bazơ
Trong hóa học, oxit lưỡng tính có một số khác biệt rõ ràng với oxit axit và oxit bazơ, điều này không chỉ liên quan đến khả năng phản ứng mà còn phản ánh trong ứng dụng của chúng. Để hiểu rõ hơn, chúng ta hãy xem xét những sự khác biệt quan trọng này qua từng tiêu chí:

-
Phản ứng hóa học:
-
Oxit lưỡng tính: Có khả năng phản ứng với cả axit và bazơ, tạo ra muối và nước.
-
Oxit axit: Chỉ phản ứng với nước để tạo thành axit, không phản ứng với bazơ.
-
Oxit bazơ: Chỉ phản ứng với axit để tạo ra muối và nước.
-
Tính ứng dụng:
-
Oxit lưỡng tính: Được ứng dụng rộng rãi trong nhiều lĩnh vực khác nhau do tính linh hoạt trong phản ứng.
-
Oxit axit và bazơ: Thường được sử dụng cho các ứng dụng cụ thể hơn, chẳng hạn như trong sản xuất hóa chất.
-
Tính chất hóa học:
Tóm lại, sự phân biệt rõ ràng giữa các loại oxit không chỉ giúp chúng ta hiểu về các tính chất hóa học của chúng mà còn cung cấp thông tin hữu ích cho việc ứng dụng trong công nghiệp và nghiên cứu.
Các câu hỏi thường gặp về oxit lưỡng tính
Khi nói về oxit lưỡng tính, một số câu hỏi thường gặp có thể giúp ích cho độc giả trong việc hiểu rõ hơn về tính chất và ứng dụng của loại hợp chất này. Dưới đây là một số câu hỏi tiêu biểu:
Tại sao oxit lưỡng tính quan trọng trong hóa học?
Oxit lưỡng tính không chỉ đơn thuần là những hợp chất hóa học, mà chúng còn giữ một vai trò rất quan trọng trong quá trình nghiên cứu và ứng dụng hóa học. Một trong những lý do đầu tiên là tính năng hóa học độc đáo của chúng. Khả năng phản ứng với cả axit và bazơ giúp oxit lưỡng tính đóng vai trò quan trọng trong các phản ứng hóa học. Điều này tạo điều kiện cho việc tạo ra muối và nước, một phần không thể thiếu trong nhiều quy trình hóa học như trung hòa và chuyển hóa chất.
Cũng nhờ vào đặc điểm này, oxit lưỡng tính có mặt trong các lĩnh vực như sản xuất gốm, chế tạo vật liệu chịu nhiệt, làm chất xúc tác trong nhiều phản ứng hóa học. Oxit nhôm (Al₂O₃) và oxit kẽm (ZnO), chẳng hạn, không chỉ là thành phần chính trong các sản phẩm công nghiệp mà còn có mặt trong sản phẩm tiêu dùng như đồ dùng nhà bếp và các sản phẩm chăm sóc sắc đẹp.
Ngành nông nghiệp cũng không đứng ngoài những lợi ích của oxit lưỡng tính. Việc sử dụng các oxit này trong phân bón giúp cung cấp các yếu tố vi lượng thiết yếu cho cây trồng, từ đó ảnh hưởng đến năng suất và chất lượng nông sản. Thông qua khả năng điều chỉnh độ pH trong đất, chúng góp phần bảo vệ sức khỏe của hệ sinh thái.
Bằng cách hiểu và ứng dụng oxit lưỡng tính, không chỉ các nhà khoa học mà mọi người đều có thể cải thiện chất lượng cuộc sống và phát triển những công nghệ mới phục vụ cho xã hội. Sự linh hoạt và đa dạng của oxit lưỡng tính chứng tỏ rằng chúng đóng một vai trò cực kỳ quan trọng trong thế giới hóa học.
Có thể tìm thấy oxit lưỡng tính ở đâu?
Oxit lưỡng tính có mặt ở khắp nơi trong cuộc sống, từ môi trường tự nhiên đến các ứng dụng công nghiệp và sản phẩm tiêu dùng. Đầu tiên, trong môi trường tự nhiên, bạn có thể tìm thấy các oxit này trong đất, đá và khoáng sản. Oxit nhôm và oxit kẽm thường xuất hiện trong nhiều loại đất khác nhau. Chúng không chỉ tồn tại trong các lớp đất mà còn tham gia vào các chu trình dinh dưỡng tự nhiên.
|
Nơi tìm thấy
|
Ví dụ
|
|
Môi trường tự nhiên
|
Oxit nhôm, oxit kẽm trong đất và đá
|
|
Ngành công nghiệp
|
Trong sản xuất gốm sứ, thủy tinh
|
|
Sản phẩm tiêu dùng
|
Trong kem chống nắng, kem trị mụn
|
Hiểu biết về oxit lưỡng tính không chỉ mở ra cánh cửa khám phá cho các nhà khoa học và sinh viên hóa học, mà còn giúp mọi người trong xã hội nhận diện được những tiềm năng ứng dụng của chúng trong cuộc sống hàng ngày. Đông Á luôn hy vọng bằng cách tiếp tục nghiên cứu và ứng dụng các hợp chất này, chúng ta có thể hướng tới một tương lai bền vững và thân thiện với môi trường hơn.