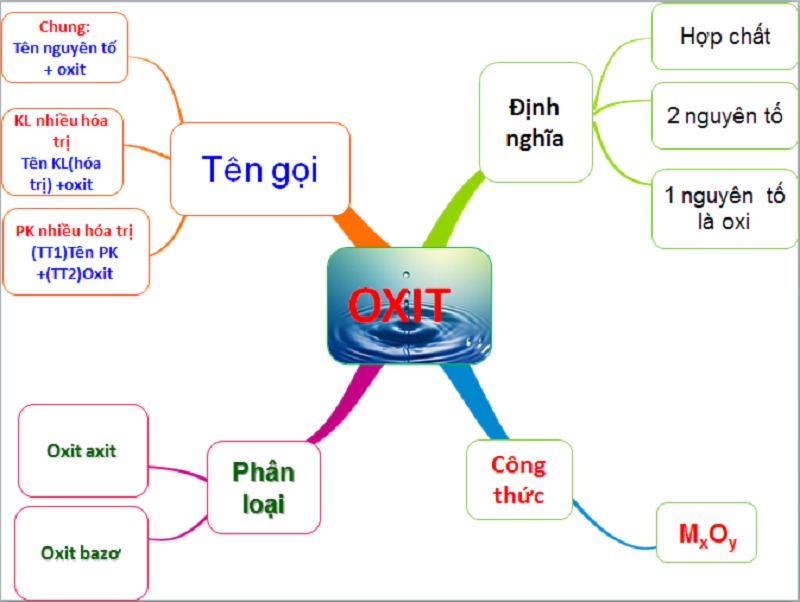
1. Oxit là gì?

Định nghĩ về oxit là gì?
Oxit thực tế là tên gọi của một loại hợp chất được hình thành từ sự kết hợp của hai nguyên tố hóa học, trong đó nguyên tố oxy là một yếu tố không thể thiếu. Công thức tổng quát của các oxit thường được biểu diễn dưới dạng MxOy.
Ở đây,
-
M đại diện cho một nguyên tố hóa học, có thể là kim loại hoặc phi kim.
-
O là nguyên tố oxy. Các chỉ số x và y được sử dụng để thể hiện sự cân bằng theo hóa trị.
-
Ví dụ điển hình bao gồm CO2, CaO, CO, CuO, Fe2O3, và nhiều loại khác.
Chúng ta có hai cách để đặt tên cho các hợp chất oxit.
-
Cách đầu tiên là gọi tên oxit dựa trên tên của nguyên tố M, sau đó thêm từ "oxit" vào cuối.
-
Cách thứ hai là sử dụng tên của kim loại kèm theo số oxi hóa (hoá trị) của nó, sau đó thêm từ "oxit" (đặc biệt quan trọng khi có nhiều hóa trị khác nhau cho kim loại phi kim).
2. Tính chất hóa học đặc trưng của oxit là gì?
Tính chất hóa học đặc trưng của oxit là gì?
Tính chất hóa học của các loại oxit đa dạng và độc đáo. Dưới đây, chúng tôi sẽ giới thiệu tính chất hóa học của một số oxit quan trọng hiện nay.
Phản ứng với nước:
Hầu hết oxit axit khi hoà tan vào nước tạo ra dung dịch axit, trừ SiO2:
Ví dụ:
- Na2O + H2SO4 → Na2SO4 + H2O
- FeO + HCl → FeCl2 + H2O
- CuO + H2SO4 → CuSO4 + H2O
Phản ứng với oxit bazơ tan:

Phản ứng với oxit bazơ tan
Oxit axit tác động với oxit bazơ tan để tạo ra muối:
Ví dụ:
- SO3 + CaO -> CaSO4
- P2O5 + 3Na2O -> 2Na3PO4
Phản ứng tùy thuộc vào tỷ lệ mol giữa oxit axit và bazơ, kết quả có thể là nước, muối trung hòa, muối axit hoặc hỗn hợp hai muối.
Với kim loại có trong bazơ với hóa trị I:
Tỷ lệ mol B: OA là 1 sẽ tạo ra muối axit, trong khi tỷ lệ mol B: OA là 2 sẽ tạo ra muối trung hòa.
Ví dụ:
- NaOH + SO2 -> NaHSO3 (Tạo muối axit)
- 2KOH + SO3 -> K2SO3 + H2O (Tạo muối trung hòa)
Với kim loại có trong bazơ với hóa trị II:
Tỷ lệ mol OA: B là 1
Với axit có trong gốc axit có hoá trị III:
Tỷ lệ mol B: OA là 6 tạo muối, B: OA là 4 tạo muối, và B: OA là 2 tạo hỗn hợp muối.
Ví dụ:
- P2O5 + 6NaOH -> 2Na2HPO4 + H2O
- P2O5 + 4NaOH -> 2Na2HPO4 + H2O
Những tính chất này phản ánh sự đa dạng và phức tạp của các oxit và cách chúng tương tác với nhau trong các phản ứng hóa học khác nhau.
3. Cách đặt tên cho các loại oxit

Cách đặt tên cho các loại oxit
Sau khi đã hiểu khái niệm oxit, chúng ta sẽ khám phá cách đặt tên cho chúng. Hiện nay, có nhiều quy tắc đặt tên oxit, tuy nhiên, chúng ta có thể phân loại chúng thành ba cách chính như sau:
Tên của oxit = Tên nguyên tố + Oxit
Cách đặt tên này thường áp dụng cho oxit chứa nguyên tố kim loại hoặc phi kim có một hoá trị duy nhất.
Ví dụ:
- K2O: Kali oxit
- NO: Nitơ oxit
- CaO: Canxi oxit
- Al2O3: Nhôm oxit
- Na2O: Natri oxit
Cách đặt tên oxit kim loại có nhiều hóa trị
Tên của oxit sẽ gồm tên của kim loại và hóa trị của nó, sau đó thêm từ "oxit."
Ví dụ:
- FeO được đọc là "Sắt(II) Oxit"
- Fe2O3 được đọc là "Sắt(III) Oxit"
Cách đặt tên oxit phi kim có nhiều hóa trị
Tên của oxit sẽ bao gồm tiền tố thứ nhất (tiếp đầu ngữ), tên của phi kim, tiền tố thứ hai (tiếp đầu ngữ), và từ "oxit." Tiền tố thứ nhất thể hiện số lượng nguyên tử của phi kim trong oxit.
Ví dụ:
- SO2: Lưu huỳnh đioxit (vì có 2 nguyên tử lưu huỳnh)
- CO2: Cacbon đioxit (vì có 2 nguyên tử cacbon)
- N2O3: Đinitơ trioxit (vì có 3 nguyên tử nitơ)
- N2O5: Đinitơ pentaoxit (vì có 5 nguyên tử nitơ)
Những quy tắc đặt tên này giúp chúng ta xác định oxit một cách chính xác và rõ ràng dựa trên thành phần và tính chất của chúng.
4. Tìm hiểu một số dạng bài tập tiêu biểu về oxit

Một số dạng bà tập về oxit
Bài tập liên quan đến oxit thường xuất hiện trong các đề kiểm tra và đề thi cấp THCS và THPT. Chúng giúp bạn nắm vững kiến thức và chuẩn bị cho bài thi một cách hiệu quả. Dưới đây, chúng tôi sẽ chia sẻ cách giải một số dạng bài tập liên quan đến oxit:
Bài tập dạng Oxit axit tác dụng với bazơ
Khi các loại oxit axit (CO2, SO2…) tác dụng cùng với dung dịch kiềm (KOH, NaOH…)
Phương trình hóa học:
CO2 + NaOH → NaHCO3
CO2 + 2NaOH → Na2CO3 + H2O
Bước 1: Xác định tỷ lệ mol giữa bazơ và oxit axit, giả sử là T.
Nếu T ≤ 1: Sản phẩm là muối axit, chỉ xảy ra phản ứng (1).
Nếu 1 < T < 2: Sản phẩm là muối axit và muối trung hòa, xảy ra cả hai phản ứng (1) và (2).
Nếu T ≥ 2: Sản phẩm là muối trung hòa, chỉ xảy ra phản ứng (2).
Bước 2: Viết phương trình phản ứng và tính toán theo phương trình đó (nếu xảy ra cả hai phản ứng, cần đặt biến và giải theo hệ phương trình).
Bước 3: Sử dụng các nguyên tắc như định luật bảo toàn khối lượng và bảo toàn nguyên tố để giải quyết các yêu cầu của đề bài.
Các loại oxit axit (CO2, SO2…) tác dụng cùng với dung dịch kiềm thổ (Ca(OH)2, Ba(OH)2…)
Phương trình phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
2CO2 + Ca(OH)2 → Ca(HCO3)2
Bước 1: Xác định tỷ lệ mol giữa bazơ và oxit axit, giả sử là T.
Nếu T ≤ 1: Sản phẩm là muối trung hòa, chỉ xảy ra phản ứng (1).
Nếu 1 < T < 2: Sản phẩm là muối axit và muối trung hòa, xảy ra cả hai phản ứng (1) và (2).
Nếu T ≥ 2: Sản phẩm là muối axit, chỉ xảy ra phản ứng (2).
Bước 2 và bước 3: Tương tự như trường hợp 1.
Bài tập này giúp bạn áp dụng kiến thức về oxit, các phản ứng hóa học và nguyên tắc bảo toàn trong các tình huống thực tế.
Bài toán về oxit và phản ứng oxit bazơ với dung dịch axit

Bài toán về oxit và phản ứng oxit bazơ với dung dịch axit
Để giải bài tập liên quan đến oxit và phản ứng oxit bazơ với dung dịch axit, bạn cần thực hiện các bước sau:
-
Viết phương trình hóa học: Đầu tiên, bạn cần xây dựng phương trình hóa học cho phản ứng giữa oxit, dung dịch axit và các sản phẩm tạo ra.
-
Xác định số mol chất đề bài: Tính toán số mol của các chất tham gia trong phản ứng bằng cách sử dụng khối lượng và khối lượng phân tử của chúng.
-
Áp dụng các định luật: Sử dụng các định luật hóa học, như định luật bảo toàn khối lượng và bảo toàn nguyên tố, để giải quyết các yêu cầu của bài tập.
Ví dụ: Khi hòa tan toàn bộ 10 gam MgO cần dùng vừa đủ với 400 ml dung dịch HCl thu được dung dịch X. Giá trị của a là
Số mol MgO = Khối lượng / Khối lượng phân tử = 10 g / 40 g/mol = 0,25 mol.
Phương trình phản ứng: MgO + 2HCl → MgCl2 + H2O. Vì mỗi mol MgO phản ứng với 2 mol HCl.
Số mol HCl cần = 0,25 mol x 2 = 0,5 mol.
Từ số mol và thể tích dung dịch HCl (0,4 L), tính được nồng độ HCl là 0,5 mol / 0,4 L = 1,25 M.
Bài tập phản ứng giữa các oxit và nước
Ví dụ: Khi cho 20 gam hỗn hợp Na2O và CuO phản ứng hết với 3,36 lít SO2 (đktc). Sau khi phản ứng thì thấy thu được một chất rắn không tan. Thành phần phần trăm tính theo khối lượng của 2 oxit trong hỗn hợp là:
Phương trình phản ứng: Na2O + SO2 → Na2SO3.
Số mol Na2O = Số mol SO2 = 3,36 L / 22,4 L/mol = 0,15 mol.
Phần trăm theo khối lượng của Na2O: (0,15 mol x 62 g/mol) / 20 g x 100% = 46,5%.
Phần trăm theo khối lượng của CuO: 100% - 46,5% = 53,5%.
(Chú ý: CuO không phản ứng với SO2)
5. Tổng kết
Như vậy, chúng tôi đã cung cấp cho bạn một cái nhìn tổng quan về oxit là gì? cách gọi tên và tính chất hóa học của chúng. Bên cạnh đó, chúng tôi đã trình bày một số dạng bài tập liên quan đến oxit, giúp bạn nắm vững kiến thức và kỹ năng giải quyết bài tập.
Nếu bạn vẫn còn bất kỳ thắc mắc nào về oxit hoặc bất kỳ hoá chất nào khác, đừng ngần ngại liên hệ với chúng tôi qua trang web này. Chúng tôi sẽ sẵn sàng giúp bạn giải quyết mọi câu hỏi hoặc khúc mắc bạn có về lĩnh vực hóa học.
Hy vọng rằng thông qua bài viết này của Đông Á Chemical, bạn đã củng cố kiến thức về oxit và sẽ tự tin hơn khi đối mặt với bài tập và vấn đề liên quan đến chúng.