Natri nitrit, một hợp chất hóa học với công thức NaNO₂, đã khẳng định vai trò không thể thiếu trong nhiều lĩnh vực, đặc biệt là trong ngành thực phẩm và công nghiệp. Với dạng bột tinh thể màu trắng hoặc vàng nhạt, natri nitrit không chỉ đóng vai trò là chất bảo quản mà còn là một yếu tố quan trọng trong quá trình chế biến thực phẩm để duy trì màu sắc và hương vị. Chúng ta hãy cùng khám phá sâu hơn về natri nitrit: từ công thức hóa học, tính chất lý hóa, ứng dụng và những mối nguy hại liên quan đến việc sử dụng nó.
Công thức hóa học và cấu trúc phân tử của natri nitrit
Natri nitrit, ký hiệu hóa học là NaNO₂, có cấu trúc phân tử thú vị mà bất kỳ ai quan tâm đến hóa học đều không thể bỏ qua. Phân tử này bao gồm một ion natri Na⁺ và một ion nitrit NO₂⁻. Sự kết hợp này tạo ra một hợp chất với nhiều đặc tính nổi bật và ứng dụng khác nhau.
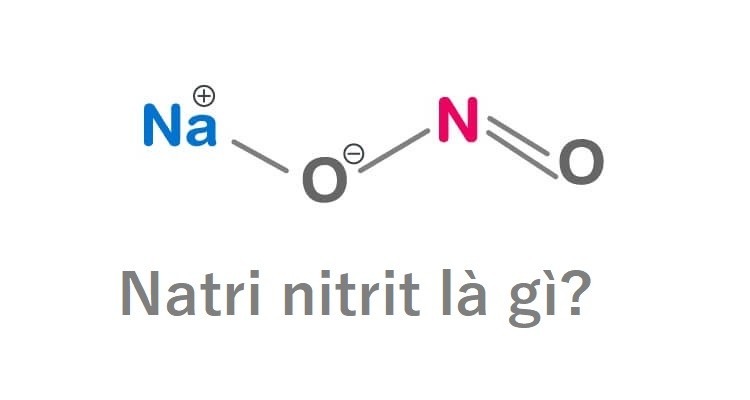
Cấu trúc phân tử của natri nitrit
Hình dạng của ion nitrit NO₂⁻ trong cấu trúc nguyên tử là kết quả của liên kết đôi giữa một nguyên tử nitơ và hai nguyên tử oxy. Cấu trúc này không chỉ đơn giản là sự kết hợp các nguyên tử mà còn thể hiện tính chất hóa học đặc trưng của natri nitrit. Dưới đây là một số thông tin đặc trưng về cấu trúc và tính chất của natri nitrit:
-
Công thức hóa học: NaNO₂
-
Khối lượng mol: 68,9953 g/mol
-
Dạng: Bột tinh thể màu trắng hoặc vàng nhạt
-
Hòa tan trong nước: Độ hòa tan khoảng 82 g/100 ml ở 20 °C
-
Điểm nóng chảy: Khoảng 271 °C
Khi nhìn vào cấu trúc của natri nitrit, ta có thể so sánh nó với hình ảnh của một bản hợp tác giữa ion natri và nitrit. Mỗi thành phần trong cấu trúc này đều tham gia vào quá trình hóa học, tạo ra những ứng dụng hữu ích trong thực tiễn. Điều này cho thấy rằng, NaNO₂ không chỉ là một hợp chất vô cơ đơn giản, mà còn là một phần quan trọng của nhiều sản phẩm hàng ngày.
Tính chất lý hóa của natri nitrit
Với công thức hóa học đã giới thiệu, tính chất lý hóa của natri nitrit càng chứng tỏ vai trò quan trọng của nó. NaNO₂ không chỉ mang lại những lợi ích trong ngành thực phẩm mà còn thể hiện nhiều đặc điểm hóa học đa dạng. Dưới đây là một cái nhìn sâu vào tính chất vật lý và hóa học của natri nitrit:
Tính chất vật lý
Natri nitrit là một hợp chất hóa học có nhiều ứng dụng trong công nghiệp và y tế. Về mặt vật lý, nó có một số đặc tính nổi bật sau:

Trạng thái tồn tại dạng tinh thể trắng của natri nitrit
-
Trạng thái: Ở điều kiện thường, NaNO₂ tồn tại ở dạng tinh thể màu trắng hoặc vàng nhạt.
-
Mùi vị: Không mùi.
-
Độ tan: Tan rất tốt trong nước, tạo thành dung dịch không màu.
-
Hút ẩm: Natri nitrit có tính hút ẩm, dễ hấp thụ hơi nước từ không khí.
-
Khối lượng riêng: Khoảng 2.17 g/cm³.
-
Điểm nóng chảy: Khoảng 271°C.
-
Điểm sôi: Khoảng 320°C.
Một số tính chất vật lý khác:
-
Tính ổn định: Ở nhiệt độ phòng và áp suất thường, natri nitrit khá ổn định. Tuy nhiên, khi đun nóng đến nhiệt độ cao hoặc tiếp xúc với các chất oxy hóa mạnh, nó có thể phân hủy.
-
Tính dẫn điện: Dung dịch NaNO₂ dẫn điện tốt.
Tính chất hóa học
Natri nitrit (NaNO₂) là một hợp chất hóa học có tính oxi hóa mạnh và thường được sử dụng trong công nghiệp thực phẩm, hóa chất và y tế. Dưới đây là một số tính chất hóa học đặc trưng của nó:
1. Tính oxi hóa mạnh:
-
Phản ứng với axit: Khi tác dụng với các axit như axit clohiđric (HCl), natri nitrit sẽ giải phóng khí nitơ oxit (NO) có màu nâu đỏ.
-
Phản ứng với các chất khử: Natri nitrit có khả năng oxi hóa nhiều chất khử khác nhau, như sắt (II) sunfat, tạo thành các sản phẩm oxi hóa cao hơn.
2. Phản ứng tạo muối diazoni:
-
Natri nitrit phản ứng với các amin thơm bậc một trong môi trường axit để tạo thành muối diazoni. Muối diazoni là những hợp chất không bền, dễ tham gia vào các phản ứng thế, tạo ra nhiều hợp chất hữu cơ khác nhau.
3. Phản ứng nhiệt phân:
4. Tác dụng với các kim loại:
5. Tác dụng với các hợp chất hữu cơ:
Các phương trình phản ứng minh họa:
-
Phản ứng với axit: NaNO₂ + HCl → NaCl + HNO₂ 3HNO₂ → HNO₃ + 2NO + H₂O
-
Phản ứng với sắt (II) sunfat: 2FeSO₄ + 2NaNO₂ + 2H₂SO₄ → Fe₂(SO₄)₃ + 2Na₂SO₄ + 2NO + 2H₂O
-
Phản ứng tạo muối diazoni: ArNH₂ + NaNO₂ + HCl → ArN₂⁺Cl⁻ + NaCl + 2H₂O (Ar là gốc aryl)
Lưu ý:
-
Các phản ứng của natri nitrit thường xảy ra nhanh và tỏa nhiệt.
-
Nhiều sản phẩm tạo thành từ các phản ứng của NaNO₂ có tính độc hại.
-
Khi làm việc với NaNO₂, cần tuân thủ các biện pháp an toàn để tránh các tai nạn đáng tiếc.
Ứng dụng của natri nitrit trong thực tế
NaNO₂ là một hợp chất hóa học có nhiều ứng dụng quan trọng trong cuộc sống hàng ngày, đặc biệt trong công nghiệp thực phẩm và y tế. Dưới đây là một số ứng dụng điển hình:
1. Công nghiệp Thực phẩm

Ứng dụng trong công nghiệp thực phẩm
-
Chất bảo quản: Ngăn chặn sự phát triển của vi khuẩn gây ngộ độc thực phẩm như Clostridium botulinum. Kéo dài thời hạn sử dụng của sản phẩm, đặc biệt là các loại thịt chế biến sẵn.
-
Chất tạo màu: Tạo màu hồng đặc trưng cho thịt, xúc xích, thịt nguội, giúp sản phẩm trông hấp dẫn hơn. Màu sắc này là do phản ứng giữa nitrit với myoglobin trong thịt.
-
Chất tăng cường hương vị: Góp phần tạo ra hương vị đặc trưng của thịt muối, thịt hun khói.
2. Công nghiệp Hóa chất

Ứng dụng sản xuất thuốc nhuộm
-
Sản xuất thuốc nhuộm: Là nguyên liệu quan trọng trong quá trình sản xuất các loại thuốc nhuộm azo.
-
Sản xuất thuốc nổ: Được sử dụng như một chất oxy hóa trong một số loại thuốc nổ.
-
Tổng hợp hữu cơ: Là chất trung gian trong quá trình tổng hợp nhiều hợp chất hữu cơ khác.
3. Ngành Y tế
-
Thuốc giãn mạch: Giúp giãn nở mạch máu, cải thiện lưu thông máu.
-
Thuốc giải độc: Dùng để giải độc trong trường hợp ngộ độc xyanua.
4. Các ứng dụng khác
Mối nguy hại và lưu ý khi sử dụng natri nitrit
Mặc dù natri nitrit mang lại nhiều lợi ích trong công nghiệp thực phẩm, nhưng việc sử dụng chất này cũng tiềm ẩn nhiều nguy cơ đối với sức khỏe con người.
Nguy cơ sức khỏe khi sử dụng natri nitrit:
-
Tạo thành nitrosamine: Khi natri nitrit kết hợp với các amin thứ cấp trong thịt, đặc biệt khi chế biến ở nhiệt độ cao, sẽ tạo ra các hợp chất nitrosamine. Đây là những chất gây ung thư mạnh, có thể làm tăng nguy cơ mắc các bệnh ung thư như ung thư dạ dày, ung thư thực quản.
-
Gây methemoglobinemia: Natri nitrit có khả năng oxy hóa hemoglobin trong máu thành methemoglobin, làm giảm khả năng vận chuyển oxy của máu. Điều này đặc biệt nguy hiểm đối với trẻ sơ sinh và trẻ nhỏ, có thể dẫn đến tình trạng thiếu oxy cấp tính, thậm chí tử vong.
-
Tác động đến hệ tim mạch: Một số nghiên cứu cho thấy việc tiêu thụ nhiều thực phẩm chứa nitrit có thể làm tăng nguy cơ mắc các bệnh tim mạch như bệnh tim mạch vành, đột quỵ.
Lưu ý khi sử dụng natri nitrit:

Lưu ý khi sử dụng natri nitrit
-
Hạn chế tiêu thụ thực phẩm chứa nhiều nitrit: Nên hạn chế ăn các loại thịt chế biến sẵn như xúc xích, thịt nguội, thịt xông khói, vì chúng thường chứa hàm lượng nitrit cao.
-
Chế biến thực phẩm đúng cách: Khi chế biến thịt, nên tránh nướng hoặc chiên ở nhiệt độ quá cao để giảm thiểu sự hình thành nitrosamine.
-
Uống nhiều nước: Nước giúp làm loãng nồng độ nitrit trong cơ thể, giảm nguy cơ gây hại.
-
Tăng cường rau xanh: Rau xanh chứa nhiều chất chống oxy hóa giúp trung hòa các gốc tự do được tạo ra từ quá trình chuyển hóa nitrit.
-
Tham khảo ý kiến bác sĩ: Nếu có bất kỳ lo ngại nào về việc sử dụng thực phẩm chứa nitrit, hãy tham khảo ý kiến của bác sĩ.
Quy định về sử dụng natri nitrit:
Để đảm bảo an toàn cho người tiêu dùng, nhiều quốc gia đã ban hành các quy định chặt chẽ về hàm lượng NaNO₂ cho phép trong thực phẩm. Các nhà sản xuất thực phẩm cũng đang tìm kiếm các giải pháp thay thế an toàn hơn cho natri nitrit.
Thông qua bài viết này, Đông Á hi vọng các bạn đã có cái nhìn tổng quan nhất về hợp chất Natri nitrit và cẩn trọng trong việc sử dụng. Người tiêu dùng nên có ý thức về những nguy cơ tiềm ẩn và lựa chọn các sản phẩm thực phẩm an toàn, hạn chế sử dụng các sản phẩm chứa nhiều nitrit.