Phản ứng hoá học giữa KClO3 và HCl không chỉ mang tính chất hoá học thú vị, nó còn được ứng dụng rộng rãi trong công nghiệp và xử lý nước. Sản phẩm thu được là Clo, muối kali clorua và nước. Hãy cùng Đông Á đi tìm hiểu chi tiết về các phương trình phản ứng giữa KClO3 + HCl thông qua bài viết dưới đây.
Tính chất của KClO3 và HCl
1. KClO3 (Kali clorat)
KClO3, hay còn gọi là kali clorat, là một chất rắn tinh thể màu trắng trông khá vô hại. Nhưng đừng để vẻ ngoài đánh lừa bạn! KClO3 là một chất oxi hóa mạnh, nghĩa là nó rất thích "chia sẻ" oxy với các chất khác. Điều này làm cho nó trở nên hữu ích trong nhiều lĩnh vực:
- Pháo hoa: KClO3 giúp tạo ra những tia sáng rực rỡ trên bầu trời đêm
- Diêm: Nó là thành phần quan trọng trong việc đánh lửa
- Y học: Đôi khi được sử dụng như một chất sát trùng
2. HCl (Axit clohydric)
HCl, hay axit clohydric, là một chất lỏng không màu với tính axit mạnh. Nó có khả năng hòa tan trong nước vô hạn và được sử dụng rộng rãi trong công nghiệp:
- Sản xuất hóa chất: HCl là nguyên liệu quan trọng trong nhiều quy trình hóa học
- Xử lý kim loại: Giúp làm sạch và xử lý bề mặt kim loại
- Điều chỉnh pH: Được sử dụng để kiểm soát độ pH trong nhiều ứng dụng
Phương trình phản ứng hoá học giữa KClO3 và HCl
KClO3 và HCl là những hóa chất được sử dụng phổ biến trong phòng thí nghiệm và trong sản xuất công nghiệp. Trong đó:
-
Kali clorat ( KClO3) là một hợp chất hóa học, tồn tại ở dạng tinh thể màu trắng, có khả năng oxi hoá mạnh và tan hoàn toàn trong nước. KClO3 được sử dụng phổ biến trong sản xuất công nghiệp, sản xuất thuốc nổ, pháo hóa, đồng thời đóng vai trò là chất tạo oxy.
-
Axit Clohidric (HCl) là một hợp chất vô cơ có tính axit mạnh, tồn tại ở dạng lỏng và dạng khí. Loại hóa chất này được sử dụng phổ biến trong dược phẩm, hoá học, sản xuất công nghiệp…
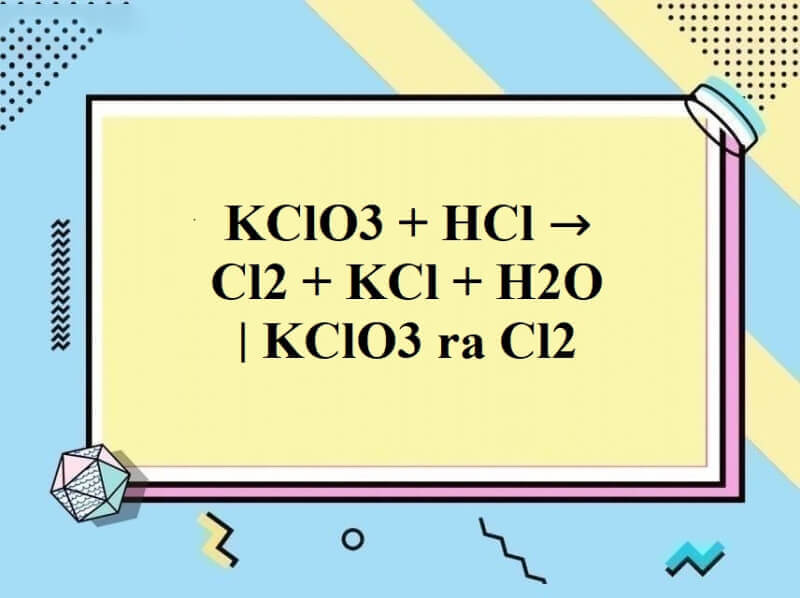
Phương trình phản ứng giữa KClO3 và HCl
1. Điều kiện phản ứng
Để phản ứng giữa Kali clorat và axit clohidric có thể xảy ra thành công thì yêu cầu một số điều kiện sau đây:
-
Nhiệt độ phản ứng ở mức nhiệt độ phòng (trong khoảng 25 độ C).
-
Tỷ lệ chất tham gia cần đúng và đủ, mỗi phân tử KClO3 tương tác với 6 phân tử HCl.
-
Hóa chất tham gia phản ứng phải đảm bảo độ tinh khiết và chất lượng, không lẫn tạp chất.
Tốc độ của phản ứng giữa KClO3 và HCl có thể bị ảnh hưởng bởi nhiều yếu tố. Hãy cùng khám phá những yếu tố chính:
- Nồng độ của các chất phản ứng
- Nồng độ cao hơn = Tốc độ phản ứng nhanh hơn
- Giống như một buổi tiệc đông người, càng nhiều "khách mời" (phân tử), cơ hội "gặp gỡ" (phản ứng) càng cao
- Diện tích tiếp xúc
- Diện tích tiếp xúc lớn hơn = Tốc độ phản ứng nhanh hơn
- Nghiền nhỏ KClO3 giống như tăng số lượng cửa vào một tòa nhà - nhiều người có thể vào cùng một lúc!
- Nhiệt độ
- Nhiệt độ cao hơn = Tốc độ phản ứng nhanh hơn
- Tăng nhiệt độ giống như cho các phân tử "uống cà phê" - chúng trở nên năng động và va chạm nhiều hơn
- Chất xúc tác
- Thêm chất xúc tác = Tốc độ phản ứng nhanh hơn
- Chất xúc tác giống như một "mai mối viên" trong thế giới hóa học - giúp các chất phản ứng "gặp gỡ" dễ dàng hơn
2. Phương trình hóa học KClO3 + HCl đặc
Phương trình phản ứng giữa KClO3 HCl đặc được diễn ra như sau:
KClO3 + 6HCl → 3Cl2 + KCl + 3H2O
Khi phản ứng xảy ra, 3 phân tử Cl2 sẽ được tạo ra khi mỗi phân từ KClO3 kết hợp với 6 phân từ HCl, 1 phân tử KCl và 3 phân tử H2O. Đây là phản ứng oxi hoá - khử, trong đó KClO3 được khử thành Cl2 và KCl, HCl được oxi hoá và tạo thành H2O.
3. Phương trình KClO3 + HCl thăng bằng e
Cân bằng phương trình hoá học theo phương pháp thăng bằng electron là việc xác định và cân bằng các phản ứng oxi hóa khử. Nó sẽ dựa trên nguyên tắc cân bằng tổng số electron cho và tổng số electron nhận của các chất khử và chất oxi hoá.
-
Bước 1: Xác định chất oxi hoá và chất khử trong phản ứng
-
Bước 2: Ghi công thức hoá học của các chất khử và chất oxi hoá.
-
Bước 3: Xác định số oxi hoá của các chất trong phản ứng (số electron cho và nhận)
-
Bước 4: Cân bằng số electron sao cho tổng số e chuyển đi bằng tổng số e được nhận.
-
Bước 5: Nhân các hệ số cân bằng với các chất tương ứng trong phương trình hoá học.
Phương trình KClO3 + HCl thăng bằng e được diễn ra như sau:
KClO3+HCl→KCl+Cl2+H2O
Cl+5+6e→Cl−1 | x1
2Cl−1→Cl2+2e | x3
=> KClO3+6HCl→1KCl+3Cl2+3H2O
4. Ứng dụng điều chế Cl2
Phản ứng KClO3 và HCl chủ yếu để điều chế ra Clo (Cl2) để ứng dụng trong phòng thí nghiệm và trong ngành công nghiệp. Sản phẩm thu được sau phản ứng sẽ được ứng dụng vào các mục đích sau đây:
-
Xử lý nước: Clo thu được sau phản ứng được dùng để diệt khuẩn, khử trùng và tiêu diệt các loại virus, vi khuẩn có trong môi trường nước.
-
Sản xuất hóa chất: Clo là một nguyên liệu quan trọng avf không thể thiếu để sản xuất các chất khử như natri hydrosulfit (Na2S2O4) và nhôm hydroxit (AlH3).
-
Điều chế chất tẩy rửa: Sản phẩm clo thu được sau phản ứng giữa KClO3 + HCl được ứng dụng để sản xuất các loại chất tẩy rửa, khử trùng, chuyên dùng để vệ sinh hồ bơi và làm sạch bề mặt.
-
Sản xuất chất oxi hóa: Clo còn được biết đến với công dụng sản xuất các chất oxi hoá mạnh như cloroform và tricloretan.
-
Nghiên cứu và học tập: Phản ứng oxi hóa khử giữa KClO3 HCl là đề tài nghiên cứu và học tập trong các phòng thí nghiệm.
An toàn khi sử dụng KClO3 và HCl
Khi làm việc với KClO3 và HCl, an toàn phải là ưu tiên hàng đầu. Đây không phải là trò chơi trong bếp - chúng ta đang làm việc với những chất hóa học mạnh mẽ! Hãy xem xét một số biện pháp an toàn quan trọng:
- Trang bị bảo hộ cá nhân
- Kính an toàn: Bảo vệ đôi mắt quý giá của bạn
- Găng tay: Giữ cho đôi tay của bạn an toàn và sạch sẽ
- Khẩu trang chống khí độc: Ngăn chặn việc hít phải khí clo độc hại
- Môi trường làm việc
- Sử dụng tủ hút: Giống như một "ống khói ma thuật", nó hút đi các khí độc hại
- Thông gió tốt: Luôn đảm bảo không khí trong lành lưu thông
- Xử lý chất thải
- Tuân thủ quy định: Mỗi loại chất thải có cách xử lý riêng
- Không đổ bừa bãi: Chất thải hóa học có thể gây hại cho môi trường
Mua axit HCl ở đâu giá tốt, uy tín, chất lượng?
Axit Clohidric HCl được sử dụng phổ biến trong nhiều lĩnh vực khác nhau ví dụ như: Sản xuất muối và hợp chất hữu cơ, điều chỉnh độ pH trong sản xuất dược phẩm, đóng vai trò làm chất tẩy rửa trong ngành dệt nhuộm, sử dụng làm chất khử trong sản xuất thực phẩm, xử lý nước và làm sạch bề mặt…Chính vì thế mà hiện nay có nhiều đơn vị, doanh nghiệp phân phối axit HCl công nghiệp với nhiều mẫu mã, xuất xứ và nồng độ khác nhau.

Đông Á là công ty sản xuất cung ứng axit HCl uy tín trên toàn quốc
Tại Đông Á, Axit HCl được sản xuất với số lượng lớn và cung cấp ra thị trường các loại HCl 32% - 35% uy tín, chất lượng với mức giá tốt nhất trên thị trường. Công ty chúng tôi hiện đang sở hữu một nhà máy sản xuất rộng hơn 35.000 mét vuông với gần 300 công nhân làm việc ngày đêm, đảm bảo cung cấp số lượng lớn hóa chất HCl phục vụ cho các phòng thí nghiệm và các lĩnh vực sản xuất công nghiệp kịp thời, đúng tiến độ.
Hiện tại, Đông Á đang là đối tác của nhiều đơn vị/ tổ chức lớn như Điện Tử SamSung, Tập đoàn Tôn Hoa Sen, Hóa chất dầu khí DMC, Hoá Chất Mỏ… Hóa chất HCl luôn sẵn hàng phục vụ quý khách từ Bắc vào Nam, hỗ trợ vận chuyển số lượng lớn. Liên hệ ngay Hotline 0822 525 525 để được báo giá HCl nhanh nhất.
Như vậy bài viết vừa rồi đã giải đáp chi tiết về phản ứng hóa học giữa KClO3 và HCl. Lưu ý rằng, khi thực hành và sử dụng axit HCl cần tuân thủ đúng quy định an toàn hóa chất, trang bị đồ bảo hộ để đảm bảo an toàn cho sức khỏe và môi trường.
Xem thêm >>>
Những nguy hiểm khi sử dụng KClO3, lưu huỳnh và than sai cách
GIẢI ĐÁP: Hóa chất KClO3 dùng để làm gì? Mua ở đâu?
Các phản ứng điển hình của axit HCl đặc
Giải đáp thông tin về axit clohydric trong dạ dày