Độ âm điện là một khái niệm trung tâm trong hóa học, liên quan đến khả năng thu hút electron của các nguyên tử khi tham gia vào việc hình thành liên kết hóa học. Nếu như một nguyên tử có độ âm điện cao, nó được xem là mạnh mẽ hơn trong việc hút electron so với những nguyên tử khác. Khả năng này không chỉ ảnh hưởng đến cấu trúc của phân tử mà còn quyết định tính chất hóa học, khả năng phản ứng và sự tương tác với các phân tử khác của nguyên liệu. Việc hiểu và đánh giá độ âm điện không chỉ giúp chúng ta có cái nhìn sâu sắc về cấu trúc hóa học mà còn cung cấp những công cụ quan trọng tron
Độ âm điện trong hóa học
Độ âm điện là một khái niệm quan trọng trong hóa học, đặc biệt khi nghiên cứu về liên kết hóa học. Nó thể hiện khả năng của một nguyên tử trong phân tử hút electron về phía mình. Càng có độ âm điện lớn, nguyên tử đó càng có xu hướng "giành giật" electron từ các nguyên tử khác.

Độ âm điện trong hóa học
Tính chất
-
Tính tương đối: Độ âm điện không phải là một giá trị tuyệt đối mà là một giá trị tương đối so sánh giữa các nguyên tử trong một phân tử.
-
Không có đơn vị: Độ âm điện thường được biểu diễn bằng các thang đo khác nhau, như thang Pauling.
-
Biến đổi tuần hoàn: Độ âm điện biến đổi tuần hoàn trong bảng tuần hoàn:
-
Ảnh hưởng bởi trạng thái hóa học: Độ âm điện của một nguyên tố có thể thay đổi nhẹ tùy thuộc vào trạng thái hóa học của nó trong hợp chất.
Vai trò
Độ âm điện đóng vai trò quan trọng trong việc:
-
Dự đoán loại liên kết hóa học:
-
Liên kết ion: Hình thành khi hiệu độ âm điện giữa hai nguyên tử lớn (thường lớn hơn 1,7).
-
Liên kết cộng hóa trị: Hình thành khi hiệu độ âm điện giữa hai nguyên tử nhỏ.
-
Dự đoán tính chất hóa học của hợp chất:
-
Tính phân cực của phân tử: Liên kết càng phân cực thì phân tử càng phân cực.
-
Tính axit, bazơ: Các hợp chất chứa liên kết phân cực mạnh thường có tính axit hoặc bazơ.
-
Tính tan: Độ phân cực của phân tử ảnh hưởng đến khả năng hòa tan của chất trong các dung môi khác nhau.
-
Giải thích các hiện tượng hóa học:
-
Sự hình thành các tinh thể ion: Các hợp chất ion có mạng tinh thể được hình thành do lực hút tĩnh điện giữa các ion dương và ion âm.
-
Sự phân cực của phân tử: Độ âm điện giúp giải thích tại sao một số phân tử có tính phân cực, dẫn đến các tương tác liên phân tử như liên kết hydro.
-
Dự đoán cấu trúc phân tử: Độ âm điện ảnh hưởng đến hình dạng không gian của phân tử.
Ví dụ minh họa
-
Phân tử NaCl: Na có độ âm điện nhỏ, Cl có độ âm điện lớn. Hiệu độ âm điện lớn nên liên kết Na-Cl là liên kết ion.
-
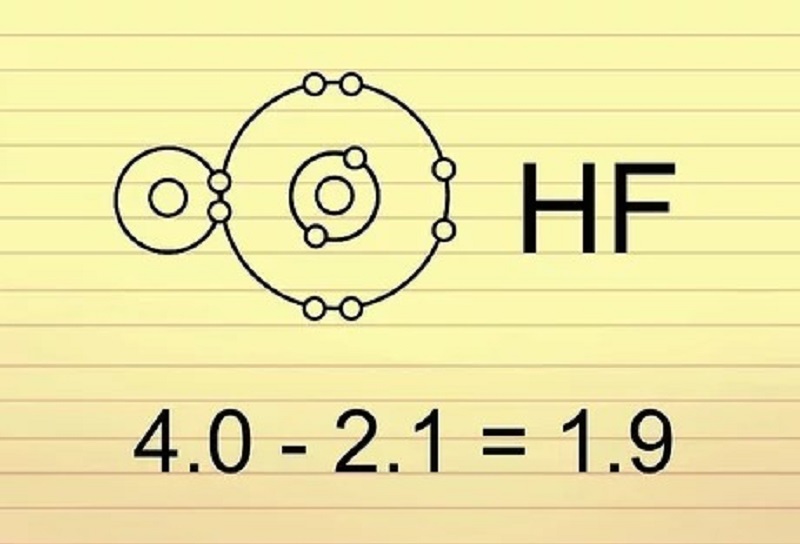
Phân tử H₂O: O có độ âm điện lớn hơn H, nên liên kết O-H là liên kết cộng hóa trị phân cực. Điều này giải thích tại sao phân tử nước có tính phân cực và có thể tạo liên kết hydro
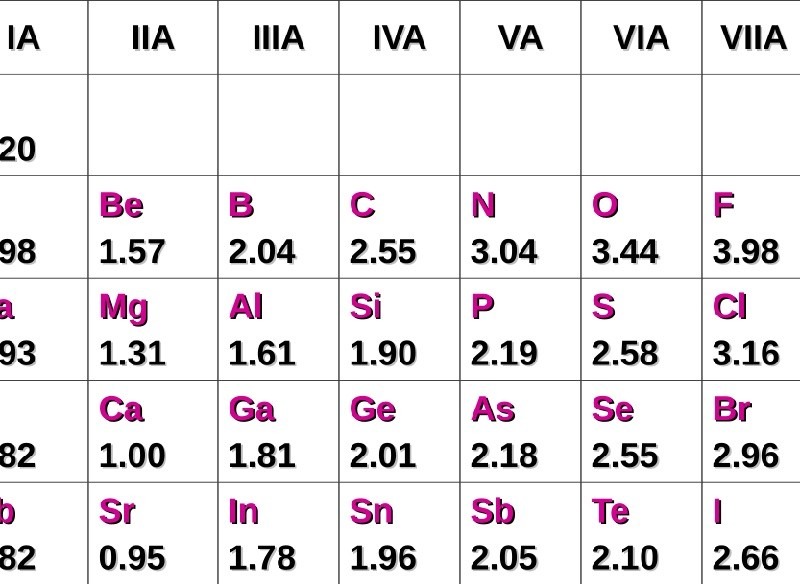
Bảng độ âm điện của các nguyên tố hóa học
Bảng độ âm điện không chỉ đóng vai trò quan trọng trong việc xác định các loại liên kết mà còn giúp các nhà hóa học dự đoán tính chất các hợp chất hóa học. Đầu tiên, chúng ta có thể thấy độ âm điện của các phi kim đều cao hơn so với kim loại, cho thấy xu hướng nhận electron mạnh mẽ. Bảng dưới đây trình bày một số giá trị độ âm điện của các nguyên tố từ các nhóm kim loại đến phi kim:
|
Nguyên tố
|
Độ âm điện
|
|
Fluor (F)
|
3.98
|
|
Oxy (O)
|
3.44
|
|
Nitơ (N)
|
3.04
|
|
Chlor (Cl)
|
3.16
|
|
Cacbon (C)
|
2.55
|
|
Lưu huỳnh (S)
|
2.58
|
|
Photpho (P)
|
2.19
|
|
Na (Natri)
|
0.93
|
|
Li (Lithium)
|
0.98
|
|
K (Kali)
|
0.82
|
Các nguyên tố và độ âm điện
Sự khác biệt về độ âm điện giữa các nguyên tố là rất rõ ràng và ảnh hưởng lớn đến các tính chất hóa học của chúng. Đối với các nguyên tố kim loại, độ âm điện thường thấp hơn, cho thấy xu hướng nhường electron để hình thành liên kết. Ngược lại, các phi kim có độ âm điện cao, thường có khả năng tạo ra liên kết bằng cách nhận electron. Sự chênh lệch này không chỉ ảnh hưởng đến cách chúng tương tác mà còn quyết định tính chất của các hợp chất mà chúng tạo thành.
Độ âm điện của phi kim
Các nguyên tố phi kim nổi bật với độ âm điện cao, thể hiện rõ khi chúng kết hợp với các nguyên tố kim loại. Những nguyên tố này thường hút electron rất mạnh mẽ để đạt được cấu hình electron bền vững. Dưới đây là danh sách độ âm điện của các phi kim chính:
|
Nguyên tố
|
Độ âm điện
|
|
Fluor (F)
|
3.98
|
|
Oxy (O)
|
3.44
|
|
Nitơ (N)
|
3.04
|
|
Chlor (Cl)
|
3.16
|
|
Brom (Br)
|
2.96
|
|
I-ốt (I)
|
2.66
|
Độ âm điện của kim loại
Ngược lại, kim loại là những nguyên tố có độ âm điện thấp, điều này chứng tỏ xu hướng mất electron khi phản ứng. Dưới đây là bảng độ âm điện của một số kim loại điển hình:
|
Nguyên tố
|
Độ âm điện
|
|
Lithium (Li)
|
0.98
|
|
Natri (Na)
|
0.93
|
|
Kali (K)
|
0.82
|
|
Magie (Mg)
|
1.31
|
|
Canxi (Ca)
|
1.00
|
|
Nhôm (Al)
|
1.61
|
Quy luật biến đổi
Sự biến đổi của độ âm điện trong bảng tuần hoàn không phải là ngẫu nhiên. Mỗi nhóm và chu kỳ đều phản ánh các quy luật riêng biệt ảnh hưởng đến độ âm điện của các nguyên tố. Khi di chuyển từ trái sang phải trong một chu kỳ, độ âm điện thường tăng lên do điện tích hạt nhân tăng lên mà không có sự gia tăng đáng kể về kích thước nguyên tử. Tuy nhiên, khi di chuyển từ trên xuống dưới trong một nhóm, độ âm điện lại có xu hướng giảm do kích thước nguyên tử gia tăng, làm giảm lực hút giữa hạt nhân và electron.
Quy luật biến đổi độ âm điện
Tóm tắt quy luật biến đổi :
-
Trong cùng một chu kỳ:
-
Trong cùng một nhóm:
Sự hiểu biết về quy luật này không chỉ giúp các nhà hóa học phân tích sâu sắc hơn về tính chất của từng nguyên tố, mà còn giúp dự đoán hành vi của chúng trong các phản ứng hóa học.
Liên kết hóa học và độ âm điện
Liên kết hóa học là kết quả của sự tương tác giữa các nguyên tử, dẫn đến việc hình thành các hợp chất. Độ âm điện đóng vai trò quan trọng trong việc xác định loại liên kết sẽ hình thành giữa các nguyên tố. Khi độ âm điện giữa hai nguyên tử khác nhau, sẽ tạo ra các loại liên kết hóa học khác nhau.
Phân loại liên kết hóa học
-
Liên kết cộng hóa trị không cực: Xuất hiện giữa các nguyên tử có độ âm điện gần giống nhau, ví dụ như phân tử H₂ hoặc Cl₂.
-
Liên kết cộng hóa trị có cực: Xảy ra khi có sự khác biệt về độ âm điện giữa các nguyên tử, dẫn đến sự phân cực, ví dụ như liên kết HCl.
-
Liên kết ion: Hình thành khi có sự chênh lệch lớn về độ âm điện.
Ứng dụng trong hóa học
Độ âm điện là công cụ mạnh mẽ trong nghiên cứu và phân tích hóa học. Nhiều ứng dụng thiết thực của độ âm điện bao gồm:
-
Xác định loại liên kết hóa học: Bằng cách so sánh độ âm điện giữa các nguyên tử, chúng ta có thể biết được loại liên kết sẽ hình thành.
-
Dự đoán tính chất hóa học: Sự phân cực trong các phân tử thường liên quan chặt chẽ đến độ âm điện, giúp dự đoán khả năng hòa tan và phản ứng hóa học.
-
Giải thích sự phân bố điện tích: Độ chênh lệch độ âm điện dẫn đến việc phân bố điện tích không đồng nhất, ảnh hưởng đến nhiều tính chất hóa học và vật lý của hợp chất.
Các yếu tố ảnh hưởng đến độ âm điện
Có nhiều yếu tố ảnh hưởng tới độ âm điện
Nhiều yếu tố có thể ảnh hưởng đến độ âm điện của một nguyên tử, trong đó có thể kể đến:
-
Kích thước nguyên tử: Nguyên tử lớn thường có độ âm điện nhỏ hơn, do electron ở xa hạt nhân.
-
Điện tích hạt nhân: Độ âm điện tăng lên khi điện tích hạt nhân tăng, do lực hút cũng tăng theo.
-
Cấu trúc electron: Sự phân bổ của electron trong các lớp cũng ảnh hưởng đến độ âm điện.
-
Tính chất liên kết: Loại liên kết cũng có thể ảnh hưởng đến độ âm điện của nguyên tử.
Các phương pháp đo độ âm điện
Có nhiều phương pháp khác nhau để đo độ âm điện, trong đó phổ biến nhất là:
-
Phương pháp Pauling: Sử dụng năng lượng liên kết để tính toán độ âm điện.
-
Phương pháp Mulliken: Đo lường bằng cách lấy trung bình năng lượng ion hóa và độ âm điện.
-
Phương pháp Allred-Rochow: Tính toán dựa trên lực hút tĩnh điện giữa hạt nhân và electron.
Thông qua bài viết trên, hóa chất Đông Á mong rằng việc hiểu biết về độ âm điện sẽ góp phần mở rộng kiến thức của chúng ta về các phản ứng hóa học, từ đó tạo điều kiện thuận lợi cho việc phát triển các ứng dụng hóa học mới trong tương lai.