Dãy điện hóa của kim loại là gì?
Trong hóa học, các cation kim loại có thể nhận thêm electron để trở thành những nguyên tử kim loại. Ngược lại, những nguyên tử kim loại cũng có thể nhường đi electron để trở thành các cation kim loại, ví dụ như:
Mg2+ + 2e ↔ Mg
Al3+ + 3e ↔ Al
Dãy điện hóa của kim loại được định nghĩa là những cặp oxi hóa – khử của kim loại được sắp xếp theo chiều giảm dần của tính khử của kim loại và tăng dần tính oxi hóa của ion kim loại.
Ý nghĩa dãy điện hóa của kim loại là gì
Căn cứ vào dãy điện hóa của kim loại mà chúng ta có thể biết được những cặp chất nào sẽ tác dụng được với nhau, từ đó xác định được những yếu tố sau:
- So sánh tính oxi hóa – khử của kịm loại: Kim loại có tính khử càng mạnh thì tính oxi hóa của ion kim loại đó càng yếu và ngược lại.

Ví dụ như:
- Kim loại Ca có tính khử mạnh thì ion Ca2+ có tính oxi hóa yếu.
- Ion Ag+ có tính oxi hóa mạnh nên kim loại của nó có tính khử yếu.
- Xác định chiều của phản ứng oxi hóa – khử: Dãy điện hóa của kim loại cho phép chúng ta dự đoán được chiều của phản ứng giữa 2 cặp oxi hóa – khử theo quy tắc alpha (α), cụ thể là chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn. Sản phẩm được tạo thành sẽ là chất oxi hóa yếu hơn và chất khử yếu hơn.
Tổng quát
Giả sử có 2 cặp oxi hóa - khử là Xx+/ X và Yy+/Y (trong đó cặp Xx+/ X sẽ đứng trước cặp Yy+/Y trong dãy điện hóa của kim loại). Cách xác định chiều của phản ứng oxi hóa – khử sẽ là:
Bước 1: Viết đúng thứ tự trong dãy điện hóa của 2 cặp oxi hóa – khử:

Bước 2: Áp dụng quy tắc α
Chúng ta sẽ có chiều xảy ra phản ứng sẽ là:
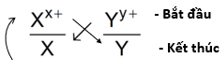
Bước 3: Xác định chiều mà phản ứng xảy ra
Yy+ (Chất oxy hóa mạnh) + X (Chất khử mạnh) → Xx+ (Chất oxy hóa yếu) + + Y (Chất khử yếu)
- Xác định xem cặp phản ứng oxi hóa - khử có xảy ra hay không: Để biết được 1 phản ứng oxi hóa – khử có xảy ra hay không, chúng ta sẽ áp dụng quy tắc , đó là:
Chất khử mạnh + Chất oxi hóa mạnh → Chất oxi hóa yếu hơn + Chất khử yếu hơn.
Ví dụ như cho Cu tác dụng với Zn2+ thì phản ứng sẽ không xảy ra do tính oxi hóa của Zn2+ yếu hơn Cu2+. Tuy nhiên, cho Ag+ tác dụng với Cu thì phản ứng lại xảy ra bình thường.
Tính chất của các kim loại có trong dãy điện hóa
Về cơ bản thì các kim loại trong dãy điện hóa cũng có các tính chất hóa học như kim loại bình thường, đó là:
Phản ứng với phi kim
Một số kim loại trong dãy điện hóa có tác dụng với phi kim và tạo ra các muối tương ứng. Một số phi kim thường gặp là oxi, lưu huỳnh và clo.
2Fe + Cl2 → 2FeCl3
4Al + O2 → 2Al2O3
Hg + S → HgS
Phản ứng với axit
Khi kim loại trong dãy điện hóa phản ứng với dung dịch axit, nó sẽ tạo ra muối và giải phóng khí hoặc nước.
Mg + 2HCl (loãng) → MgCl2 + H2
3Cu + HNO3 (loãng) → 3CuSO4 +2NO + 4H2O
Phản ứng với nước
Những kim loại thuộc nhóm IA, IIA sẽ tham gia phản ứng với nước để tạo thành dung dịch kiềm và giải phóng khí hidro.
2Na + 2H2O → 2NaOH + H2
Phản ứng với muối
Kim loại trong dãy điện hóa tác dụng với muối sẽ tạo ra muối mới và kim loại mới
CuSO4 + Fe → Cu + FeSO4
Hướng dẫn cách ghi nhớ dãy điện hóa kim loại
Trong dãy điện hóa kim loại, những kim loại đứng trước sẽ có tính khử mạnh hơn những kim loại đứng phía sau nó. Điều này đồng nghĩa với việc những cation đứng phía sau sẽ có tính oxi hóa mạn hơn những cation đứng phía trước. Để dễ dàng ghi nhớ thứ tự kim loại trong dãy điện hóa, các bạn hãy học thuộc bài thơ sau:

Một số vấn đề cần lưu ý khi làm bài tập về dãy điện hóa của kim loại
- Trong dãy điện hóa kim loại, những kim loại đứng trước hidro có thể tác dụng được với axit (HCl, H2SO4 loãng) và giải phóng hidro.
- Những kim loại đứng phía trước sẽ có tính khử mạnh hơn những kim loại đứng ở sau nó. Tức là phản ứng hóa học khi cho kim loại vào dung dịch muối chính là phản ứng kim loại mạnh đẩy kim loại yếu hơn ra khỏi muối.
- Thứ tự của phản ứng hóa học khi cho kim loại có tính khử mạnh hơn tác dụng với một dung dịch có chứa hỗn hợp các muối tan của nhiều kim loại có tính khử yếu hơn sẽ là: Kim loại sẽ tác dụng với cation kim loại có tính oxi hóa mạnh hơn trước, sau đó mới đến những cation có tính oxi hóa giảm dần phía sau.
Tuy nhiên, có một số trường hợp ngoại lệ trong quy tắc α, đó là: Khi cho kim loại kiềm một số kim loại kiềm thổ như Na, K, Ca, Li,… vào dung dịch muối, kim loại sẽ phản ứng với nước trước, sau đó tạo ra bazo. Bazo này mới chính là chất sẽ phản ứng với dung dịch muối.
Hướng dẫn giải một số bài tập về dãy điện hóa kim loại
Bài 1: Xác định tính oxi hóa theo chiều giảm dần của các ion kim loại sau: Mg2+, Fe3+, Fe2+ Cu2+, Ag+ .
Lời giải:
Căn cứ vào thứ tự các kim loại trong dãy điện hóa, ta sẽ xác định được thứ tự của các ion kim loại theo chiều giảm dần của tính oxi hóa là: Ag+, Fe3+, Cu2+, Fe2+, Mg2+.
Bài 2: Xác định chiều phản ứng giữa 2 cặp Cu2+/ Cu và Fe2+/ Fe.
Lời giải:
Theo dãy điện hóa kim loại, cặp Fe2+/ Fe đứng ở phía trước cặp Cu2+/ Cu. Theo quy tắc alpha, ta có chiều của phản ứng sẽ là:
Cu2+ + Fe → Cu + Fe2+
Tức là phản ứng sẽ xảy ra theo chiều ion Cu2+ oxi hóa kim loại sắt để tạo thành kim loại đồng và Fe2+
Bài 3: Phản ứng nào dưới đây không thể xảy ra.
A. Cu2++ Mg → Cu + Mg2+
B. Cu2++ Fe → Cu + Fe2+
C. Cu + Zn2+→ Cu2++ Zn
D. Cu + 2Ag+→ Cu2++ 2Ag
Lời giải:
Theo thứ tự các kim loại trong dãy điện hóa, ta sẽ thấy tính oxi hóa của Zn2+ yếu hơn Cu2+, do đó Zn2+ không thể nào oxi hóa được kim loại đồng thành Cu2+. Tức là đáp án C là lựa chọn đúng.
Bài 4: Sắp xếp các kim loại Mg, Al, Cu, Zn theo thứ tự tăng dần của tính oxi hoá của ion kim loại.
Lời giải:
Căn cứ vào dãy điện hóa kim loại, thứ tự tính oxi hóa của ion kim loại tăng dần sẽ là Cu2+, Zn2+, Al3+, Mg2+.
Bài 5: Xác định tính khử giảm dần của những kim loại sau: Ag, Zn, Fe, Al, Cu.
Lời giải:
Trong dãy điện hóa kim loại, thứ tự của các kim loại sẽ là Al, Zn, Fe, Cu, Ag. Điều này đồng nghĩa với việc tính khử của kim loại sẽ giảm dần từ Al, Al, Zn, Fe, Cu đến Ag.
Bài 6: Ngâm một chiếc đinh sắt trong 200 ml dung dịch đồng sunfat CuSO4. Kết thúc phản ứng, lấy đinh sắt đi rửa và làm khô thì thấy khối lượng sắt tăng 0,8 gam. Hãy xác định nồng độ của dung dịch CuSO4.
Lời giải:
Fe + CuSO4 → FeSO4 + Cu
Ta có: mFe tăng = mCu được tạo ra (bám vào) – mFe ban đầu
Gọi số mol là a và theo phương trình phản ứng, ta có 0,8 = 64a – 56a → a = 0,1 mol =>
Nồng độ mol của dung dịch đồng sunfat là: CM(CuSO4) = 0,1/0,2 = 0,5M
Việc nắm được các thông tin về dãy điện hóa của kim loại sẽ rất hữu ích cho các bạn trong việc làm bài tập hóa học và nghiên cứu. Hy vọng những kiến thức mà chúng tôi vừa chia sẻ ở trên sẽ giúp các bạn học tập và nghiên cứu các vấn đề liên quan đến bộ môn hóa học. Hãy theo dõi website https://dongachem.vn/ để xem thêm nhiều bài viết mới nhé!