Nồng độ mol, hay còn gọi là molarity, là một khái niệm quan trọng trong hóa học, đóng vai trò trung tâm trong việc nghiên cứu các phản ứng hóa học cũng như tính toán lượng chất phản ứng trong dung dịch. Là đại lượng cho biết số mol chất tan có trong 1 lít dung dịch. Nó thường được sử dụng để biểu thị nồng độ của các dung dịch trong hóa học. Chính vì thế, bài viết này sẽ giúp bạn hiểu rõ về công thức tính nồng độ mol, các phương pháp liên quan đến nó, cũng như ứng dụng trong thực tế.
Công thức tính nồng độ mol cơ bản nhất

Công thức tính nồng độ mol cơ bản nhất
Công thức cơ bản để tính nồng độ mol (C_m) của dung dịch liên quan đến số mol chất tan (n) và thể tích dung dịch (V) như sau:
Cₘ = n / V
Trong đó:
-
( Cm ) là nồng độ mol (đơn vị: mol/lít).
-
( n ) là số mol chất tan (đơn vị: mol).
-
( V ) là thể tích dung dịch (đơn vị: lít).
Các đơn vị nồng độ mol thông dụng
Nồng độ mol (molarity) là một cách quan trọng để mô tả nồng độ của chất tan trong dung dịch. Các đơn vị nồng độ mol thông dụng mà bạn có thể gặp trong hóa học bao gồm:
-
Mol trên lít (mol/L hoặc M): Đây là đơn vị phổ biến nhất được sử dụng trong hóa học để chỉ nồng độ mol.
-
Milimol trên lít (mmol/L): Thường được sử dụng trong các ứng dụng y học và sinh học, phù hợp với nồng độ rất thấp.
-
Micromol trên lít (µmol/L): Thích hợp khi nồng độ ở mức rất thấp, cần thiết trong nghiên cứu phân tích.
Cách diễn đạt này không chỉ rõ ràng mà còn dễ hiểu, giúp bạn nắm bắt được thông tin một cách nhanh chóng. Khi tính toán, bạn cần phải chuyển đổi giữa các đơn vị này để đảm bảo sự chính xác trong các ứng dụng thực tế.
Việc hiểu biết và áp dụng đúng các đơn vị nồng độ mol là rất quan trọng trong lĩnh vực hóa học. Chúng không chỉ giúp định lượng chất tan một cách chính xác mà còn ảnh hưởng đến kết quả của các thí nghiệm và phản ứng hóa học. Đặc biệt trong các ngành như dược phẩm, thực phẩm và môi trường, việc tuân thủ đúng các đơn vị nồng độ giúp đảm bảo chất lượng sản phẩm và an toàn cho người tiêu dùng.
Các bước tính nồng độ mol chi tiết
Để tính nồng độ mol cần thực hiện các bước chi tiết
Khi đã biết các khái niệm và công thức liên quan, chắc chắn bạn sẽ muốn thực hiện các bước tính nồng độ mol một cách chính xác. Dưới đây là hướng dẫn tóm tắt các bước chi tiết để tính nồng độ mol mà bạn cần nắm vững.
Tính số mol (n):
-
Nếu biết khối lượng chất tan (m) và khối lượng mol (M): n = m/M
-
Nếu biết thể tích khí ở điều kiện tiêu chuẩn (V) và biết đây là khí: n = V/22,4 (ở đktc)
Đổi đơn vị thể tích: Đảm bảo thể tích dung dịch được tính bằng đơn vị lít (L). Nếu ban đầu cho theo đơn vị ml, ta chia cho 1000 để đổi sang lít.
Áp dụng công thức: Thay các giá trị đã tính được vào công thức Cₘ = n / V để tính nồng độ mol.
Tính nồng độ mol của dung dịch NaCl chứa 58,5 gam NaCl trong 500ml dung dịch.
-
Bước 1: Tính số mol NaCl:
-
Khối lượng mol của NaCl (MNaCl) = 23 + 35,5 = 58,5 g/mol
-
Số mol NaCl (n) = m/M = 58,5g / 58,5g/mol = 1 mol
-
Bước 2: Đổi thể tích: 500ml = 0,5 lít
-
Bước 3: Tính nồng độ mol:
Vậy nồng độ mol của dung dịch NaCl là 2M.
Ứng dụng của nồng độ mol trong hóa học
Nồng độ mol đóng vai trò quan trọng trong nhiều lĩnh vực hóa học, không chỉ đơn thuần là số liệu mà còn là công cụ hữu ích giúp nhà hóa học nắm bắt và điều khiển các phản ứng hóa học. Bằng cách hiểu rõ nồng độ mol, bạn có thể sử dụng nó để phục vụ cho nhiều mục đích khác nhau.
Xác định nồng độ các dung dịch

Xác định nồng độ các dung dịch
Nồng độ mol giúp các nhà hóa học xác định chính xác lượng chất tan có trong dung dịch, từ đó điều chỉnh các thí nghiệm và phản ứng hóa học. Giống như một nhạc trưởng chỉ huy dàn nhạc, nồng độ mol giúp đảm bảo rằng tất cả các thành phần điều hòa quyện một cách hoàn hảo.
Tính toán lượng chất trong phản ứng
Với nồng độ mol, các nhà hóa học có thể dễ dàng tính toán số mol cần thiết cho một phản ứng hóa học. Điều này giúp dự đoán lượng sản phẩm tạo ra và xác định các điều kiện tối ưu nhất cho phản ứng. Cảm giác như bạn là một chiến lược gia đang điều hành một trận chiến, nơi mỗi quân cờ (chất hóa học) cần phải được bố trí một cách thông minh.
Tính toán nồng độ cuối cùng khi pha loãng
Khi pha loãng dung dịch, nồng độ mol giúp tính toán nồng độ của dung dịch sau khi trộn. Đây là một trong những ứng dụng thiết thực nhất của nồng độ mol trong cuộc sống hàng ngày, từ việc pha chế thuốc đến sản xuất thực phẩm.
Nghiên cứu và phát triển sản phẩm
Nồng độ mol còn hỗ trợ trong việc phát triển các sản phẩm mới trong lĩnh vực dược phẩm và hóa chất, giúp các nhà nghiên cứu đảm bảo được sự chính xác và công thức phù hợp cho sản phẩm của họ.
Những ứng dụng quý báu của nồng độ mol không chỉ đưa đến cho chúng ta những hiểu biết sâu sắc hơn về hóa học mà còn mở ra những cơ hội trong nghiên cứu và phát triển sản phẩm mới. Nếu nắm vững kiến thức về nồng độ mol, bạn sẽ tự tin hơn trong việc sử dụng nó để giải quyết các vấn đề và thách thức trong lĩnh vực hóa học.
Các vấn đề thường gặp khi tính nồng độ mol
Khi tính nồng độ mol, người học và chuyên gia có thể gặp phải một số vấn đề phổ biến. Nhận diện được các vấn đề này sẽ giúp bạn tránh khỏi những sai sót không đáng có và nâng cao khả năng tính toán chính xác trong hóa học.
Chưa chuyển đổi đơn vị thể tích về lít
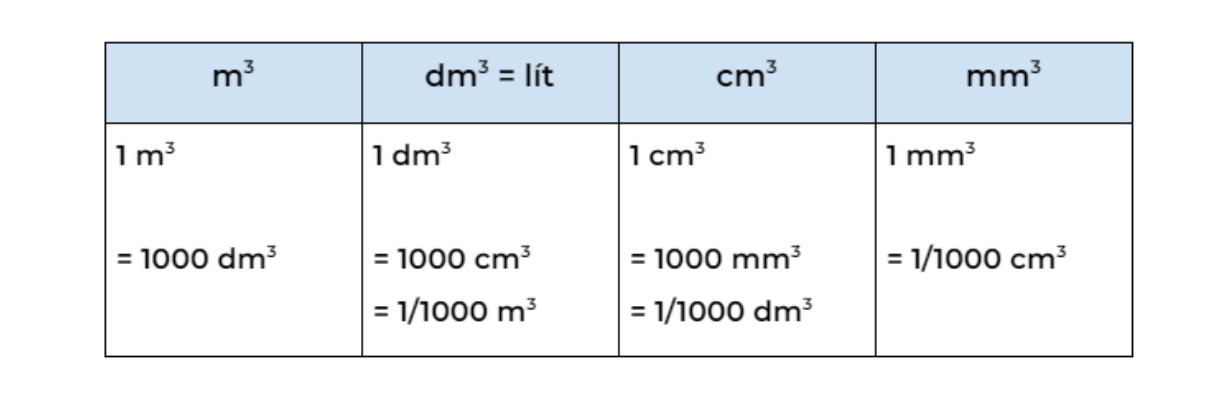
Chưa chuyển đổi đơn vị thể tích về lít
Việc quên chuyển đổi thể tích từ mililit sang lít là một trong những sai lầm thường gặp nhất. Điều này làm sai lệch kết quả tính toán và có thể dẫn đến các quyết định sai lầm trong thực hành hóa học.
Cách sửa chữa : Luôn đảm bảo rằng thể tích dung dịch được chuyển đổi sang lít trước khi áp dụng công thức tính nồng độ mol. Bạn nên tạo một thói quen kiểm tra đơn vị trước khi tính toán.
Sử dụng sai phân tử khối
Sai sót trong việc tra cứu phân tử khối có thể dẫn đến tính toán sai số mol chất tan. Việc này có thể xảy ra khi bạn không kiểm tra cẩn thận biểu đồ phân tử.
Cách sửa chữa: Kiểm tra cẩn thận phân tử khối trong bảng tuần hoàn và sử dụng số liệu chính xác khi tính toán. Đừng ngần ngại ghi lại các phân tử khối quan trọng để thuận tiện cho việc tra cứu.
Không xác định chính xác khối lượng chất tan
Khi không cân chính xác, kết quả số mol chất tan tính toán sẽ không đúng. Lưu ý đến độ chính xác của thiết bị cân.
Cách sửa chữa: Luôn sử dụng cân điện tử ở mức độ chính xác cao và thực hiện lại phép đo khi cần thiết.
Nhầm lẫn giữa nồng độ mol và nồng độ phần trăm
Nhiều người thường hay nhầm lẫn giữa hai khái niệm này, dẫn đến việc áp dụng công thức không chính xác.
Cách sửa chữa: Cần phân biệt rõ ràng hai khái niệm và sử dụng công thức phù hợp cho từng trường hợp cụ thể. Bạn có thể ghi nhớ các từ khóa quan trọng giúp cải thiện khả năng phân biệt.
Không hiểu rõ bài toán
Nhiều người cảm thấy khó khăn khi không chắc chắn về yêu cầu của bài toán hoặc cách thức thực hiện nó.
Cách sửa chữa: Đặt câu hỏi để hiểu rõ về yêu cầu của bài toán và nghiên cứu kỹ trước khi bắt đầu tính toán. Việc giao tiếp với bạn bè hoặc giảng viên có thể giúp bạn giải tỏa những nghi ngờ.
Hy vọng rằng bài viết của Đông Á đã giúp bạn hiểu rõ hơn về công thức tính nồng độ mol, các phương pháp tính khác nhau và ứng dụng của chúng trong thực tế. Đừng ngần ngại tìm hiểu sâu hơn và thực hành thường xuyên để vận dụng kiến thức này một cách hiệu quả!