Axit sunfuric là gì?
Khái niệm cơ bản về axit sunfuric là gì?
Axit sunfuric có công thức hóa học là H2SO4, tồn tại dưới dạng chất lỏng không màu, không mùi vị, không bay hơi. Axit H2SO4 nặng hơn nước và có khả năng tan vào không khí với bất cứ nồng độ nào. Đây là một loại axit được đánh giá rất cao và được sử dụng phổ biến trong các ngành hoá học. Và cũng là chất được dùng làm xúc tác cho rất nhiều các phản ứng hoá học.
Bạn có thể dễ dàng tìm thấy loại axit này ở bất cứ nơi đâu. Mà dễ tìm và dễ phân biệt nhất là trong nước mưa. Nếu bạn dính nước mưa và cảm giác ngứa ngáy, khó chịu thì đó là do tác dụng của axit sunfuric.
Hiện nay, không có một nhà khoa học nào tìm thấy mẫu H2SO4 tinh khiết trên Trái Đất. Tuy nhiên, hóa chất này chỉ tồn tại dưới dạng dung dịch có lẫn nhiều hỗn hợp các chất hữu cơ với nhau. Và vì thế mà H2SO4 tinh khiết cần được điều chế bằng phản ứng hóa học từ nhiều hợp chất khác nhau.
Tìm hiểu tính chất cơ bản của axit sunfuric H2SO4
Axit sunfuric có hai loại, axit sunfuric loãng và axit sunfuric đặc. Mỗi loại sẽ có các tính chất vật lý và tính chất hoá học khác nhau.
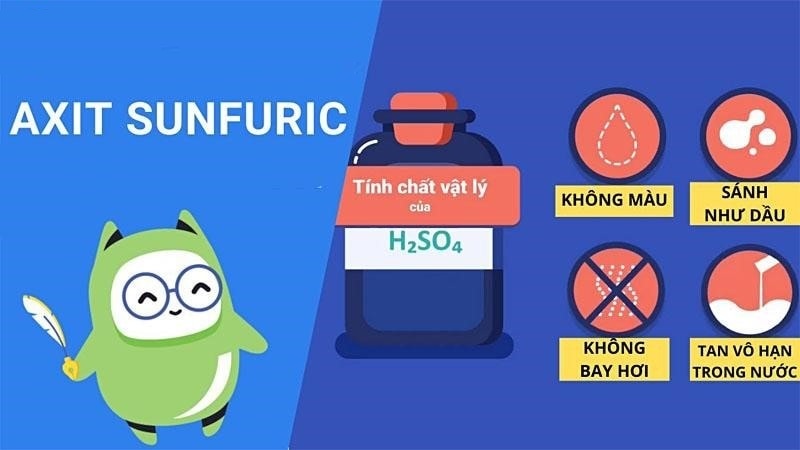
Tìm hiểu tính chất vật lý của axit sunfuric H2SO4
Như đã đề cập, axit H2SO4 đặc hay lỏng đều có đặc điểm là tồn tại dưới dạng lỏng, không màu, không mùi và không vị. Axit H2SO4 loãng có đặc điểm là khó bay hơi và hoà tan hoàn toàn trong nước. Còn H2SO4 đặc nổi bật với khả năng hút nước cực tốt và tỏa nhiều nhiệt.
Vì vậy bạn chú ý không được đổ nước vào axit mà chỉ được phép đổ axit vào nước. Để tránh trường hợp gây bỏng xảy ra khi nước tiếp xúc với axit. Và H2SO4 cũng có thể pha loãng ra để thành H2SO4 loãng. Nhưng bạn nhớ tuân thủ những quy trình ở trên để không gặp phải trường hợp xấu.
Tìm hiểu tính chất hoá học của axit sunfuric H2SO4
-
Đối với axit sunfuric loãng: Đây là một loại axit có tính chất cực mạnh nên có tất cả các đặc tính hoá học của một loại axit thông thường. Điển hình như: làm đổi màu quỳ tím thành đỏ hay phản ứng với các axit, bazo, oxit bazo, muối nhằm sản xuất ra các hợp chất hoá học theo ý muốn.
-
Đối với axit sunfuric đặc: Axit sunfuric đặc có các tính chất giống với axit sunfuric loãng. Ngoài ra, còn một vài điểm khác biệt của các axit đặc như là: Khi phản ứng với sắt, thêm đồng (Cu) vào thì dung dịch sẽ tạo ra màu xanh. Và axit H2SO4 đặc cũng có tính kiềm cực mạnh. Ví dụ khi lấy H2SO4 cho vào chén nước trắng thì chỉ sau một vài phút nước sẽ chuyển sang màu đen và có hiện tượng tuôn trào
Phương pháp điều chế axit sunfuric H2SO4

Phương pháp điều chế axit sunfuric H2SO4
Để sản xuất axit sunfuric, người ta sử dụng một trong ba phương pháp điều chế cơ bản bằng công nghệ là: công nghệ tiếp xúc, công nghệ NOx và công nghệ CaSO4. Những phương pháp này đều sử dụng chung một nguyên lý để điều chế để thu được axit tinh khiết nhất.
Nguyên lý chung của những công nghệ trên chính là thu SO2 từ những nguyên liệu đầu vào khác nhau bao gồm: lưu huỳnh, pyrit, chalcopyrit, sphalerit, galenit, CaSO4. Những loại khí hoá lỏng, khí thải có lưu huỳnh oxit, ... Tiếp theo, SO2 được oxy hoá thành SO3 trong các thiết bị tiếp xúc có sử dụng xúc tác. Cuối cùng, SO3 được hoà tan trong axit đậm đặc để thành axit H2SO4.
Trong 3 công nghệ trên, công nghệ tiếp xúc là phương pháp phổ biến và được sử dụng rộng rãi nhất. Về nguyên liệu, người ta thường sử dụng nguyên liệu lưu huỳnh hoặc quặng pirit để chế tạo axit sunphuric. Trước đây, khi không có quặng pirit, người Đức đã sử dụng nguyên liệu CaSO4 (anhydrit) cho sản xuất axit sunfuric. Vừa để tích hợp cùng quy trình sản xuất xi măng, mà vừa mang lại hiệu quả kinh tế cao.
Theo phương pháp sử dụng công nghệ tiếp xúc, có 2 loại dây chuyền sau:
Dây chuyền tiếp xúc và hấp thụ 1 lần (tiếp xúc đơn) phổ biến
Dây chuyền tiếp xúc đơn được áp dụng phổ biến trước với hiệu suất chuyển đổi SO2 thành SO3 chỉ đạt 98%. Lượng SO2 không chuyển hoá bị thải vào không khí, làm ô nhiễm môi trường. Do đó hiện nay người ta không sử dụng phương pháp trên nữa mà thay vào đó là phương pháp tiếp xúc đôi.
Dây chuyền tiếp xúc và hấp thụ 2 lần (tiếp xúc kép) hiệu suất chuyển hóa tốt
Hiện nay, nhằm đáp ứng các yêu cầu về ô nhiễm môi trường, dây chuyền tiếp xúc đơn dần bị loại bỏ và thay thế vào đó là dây chuyền tiếp xúc kép với hiệu suất chuyển hóa SO2 đạt khoảng 99,5% – 99,9%.
Với dây chuyền này, lượng SO2 trong khí thải được đảm bảo nằm trong ngưỡng cho phép khoảng 500 mg/m3, mù axit sunphuric đạt 35 mg/m3. Số liệu này đạt theo tiêu chuẩn TCVN 5939 – 1995, tiêu chuẩn về khí thải công nghiệp.
Có thể thấy, về cơ bản công nghệ sản xuất axit sunfuric trên thế giới đã phát triển và ổn định ở mức độ khá cao. Hiện nay, xu hướng phát triển công nghệ trên thế giới tập trung chủ yếu vào nâng cao hiệu suất sử dụng năng lượng, nguyên liệu và giảm phát tán khí độc vào môi trường.
Các tiêu chuẩn chủ yếu đối với những dây chuyền sản xuất axit sunfuric thế hệ mới là cắt giảm chi phí năng lượng đến mức tối thiểu. Đồng thời phải đáp ứng những tiêu chuẩn rất khắt khe về bảo vệ môi trường. Dây chuyền sản xuất phải có khả năng thu hồi tối ưu lưu huỳnh và năng lượng, xử lý tốt khí thải, sản phẩm phụ và tái xử lý. Đồng thời phải được vận hành đơn giản, thuận tiện và tuân thủ những tiêu chuẩn cao về môi trường.
Một số lưu ý quan trọng khi sản xuất axit sunfuric H2SO4

Một số lưu ý quan trọng khi sản xuất H2SO4
Trong quá trình sản xuất axit H2SO4 sẽ sản sinh ra SO2, SO3 là các hoá chất cực độc. Hay bản thân axit H2SO4 cũng gây bỏng khi tiếp xúc với da người. Vì vậy khi điều chế, sản xuất axit sunfuric cần chú ý:
-
Mang đủ trang bị bảo hộ như: gang tay, kính bảo hộ, mặt nạ chống độc, găng tay, khẩu trang, quần áo bảo hộ.
-
Nước thải sinh ra trong quá trình sản xuất chứa nhiều chất độc hại nên cần phải xử lý trước khi xả vào hệ thống nước thải chung.
-
Lưu trữ, bảo quản H2SO4 trong các hộp nhựa, xốp, ở nơi khô ráo, thoáng mát, cách xa những hoá chất ăn mòn hoặc có tính bazo
Một số ứng dụng phổ biến của axit sunfuric H2SO4

Một số ứng dụng phổ biến của axit sunfuric H2SO4
Được ví như “vua” của các loại hóa chất, axit H2SO4 được ứng dụng rộng rãi trong mọi lĩnh vực của đời sống. Đặc biệt là chất hoá học đóng vai trò quan trọng trong các ngành công nghiệp.
Trong công nghiệp sản xuất: Axit sunfuric H2SO4 có mặt trong hầu hết các ngành công nghiệp như: luyện kim, phẩm màu, hóa chất xây dựng, giấy, sợi. Theo thống kê mỗi năm có hơn 160 triệu tấn H2SO4 được sản xuất ra nhằm đáp ứng những ngành công nghiệp này.
Sản xuất phân bón: Một ứng dụng chủ yếu của H2SO4 là dùng sản xuất phân bón. Đây là một trong các thành phần phổ biến nhất dùng trong các loại phân bón. Các loại phân bón chủ yếu làm từ H2SO4 gồm: Phosphate, Canxi dihydrogen, Amoni Phosphate, Amoni Sunfat. ..
Xử lý nước thải: Axit H2SO4 là chất hoá học cơ bản dùng trong sản xuất nhôm hidroxit. Đây là một thành phần không thể thiếu khi xử lý nước trong các nhà máy. Nhôm hidroxit sẽ có tác dụng loại bỏ các tạp chất, khử khuẩn cho nước, cân bằng độ pH trong nước. Đặc biệt quan trọng là dùng để khử những kim loại nặng trong nước như Mg, Ca, để tránh nguy cơ nước bị nhiễm phèn.
Vài lưu ý khi sử dụng axit sunfuric là gì?
Theo đặc tính hoá học của H2SO4 thì đây là một axit cực mạnh. Vì vậy khi dùng chất hoá học này mọi người cần phải lưu ý các vấn đề như:
-
Không được tiếp xúc trực tiếp với axit sunfuric - H2SO4 nguyên chất hay được pha loãng. Bởi hóa chất này sẽ gây phỏng da cực mạnh, thậm chí gây bỏng nếu phun vào mắt, ...
-
Những vật dụng bằng vải hay giấy sẽ bốc khói nếu tiếp xúc với H2SO4 vì thế bạn hãy cất giữ hóa chất này ở nơi thật an toàn.
-
Khi pha H2SO4 chỉ được pha theo hướng axit chảy vào dung dịch và không có hướng ngược lại. Phải rót từ từ H2SO4 vào dung dịch nếu không sẽ gây hiện tượng trào và phun axit rất nguy hiểm.
-
Phải chọn mua H2SO4 tại các địa chỉ uy tín, chất lượng nhằm đảm bảo độ an toàn, chất lượng khi sử dụng.
Trên đây là tất tần tật thông tin cơ bản nhất về axit sunfuric là gì? Cùng với nhiều ứng dụng nổi bật của loại axit này mà chúng tôi muốn giới thiệu đến bạn đọc. Hy vọng bài viết của Hóa Chất Đông Á đã mang đến cho bạn đọc nhiều kiến thức bổ ích về các chất hóa học!