Amin là một trong những nhóm hợp chất hữu cơ có vai trò vô cùng quan trọng trong hóa học và sinh học. Chúng tồn tại dưới nhiều hình thức khác nhau, từ những chất khí nhẹ nhàng như metylamin cho đến những chất lỏng và rắn bền vững hơn. Tính chất độc đáo của amin không chỉ thể hiện trong cấu trúc hóa học của chúng mà còn tích hợp sâu sắc trong mọi hoạt động sống của sinh vật, từ việc cấu thành protein cho đến vai trò như những chất dẫn truyền thần kinh.Do đó, để hiểu rõ về amin là gì, hãy cùng Đông Á Chemical tìm hiểu về khái niệm này nhé.
Khái niệm amin là gì?
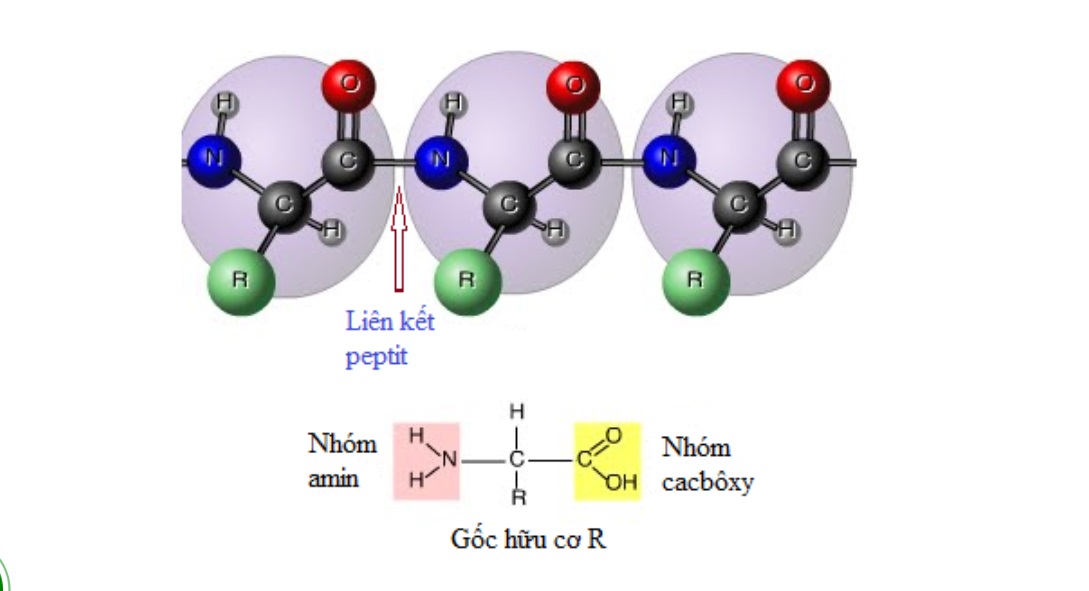
Amin là một nhóm hợp chất hữu cơ chứa nguyên tử nitrogen (N) trong cấu trúc của chúng. Cụ thể, amin được hình thành khi một hoặc nhiều nguyên tử hydro trong phân tử amoniac (NH₃) được thay thế bằng các gốc cacbon (alkyl hoặc aryl). Các amin có thể được phân loại dựa theo số lượng gốc cacbon thay thế, từ đó chúng được chia thành ba loại chính: amin bậc 1, bậc 2 và bậc 3.
Khái niệm amin là gì?
Các amin có mặt trong nhiều lĩnh vực khác nhau, từ y học cho đến nông nghiệp, hay trong công nghiệp hóa chất. Do đó, khi nhắc đến amin, chúng ta không chỉ đang nói về một nhóm hợp chất mà còn đang khám phá những mảnh ghép lắp ghép tạo nên nhiều hệ thống sống, từ những tế bào nhỏ nhất cho đến những cơ thể sống vĩ đại.
Cấu tạo của amin
Cấu tạo của amin rất đa dạng nhưng có một điểm chung là chúng đều mang nhóm chức amino -NH₂ gắn liền với nguyên tử carbon. Cấu trúc tổng quát của amin có thể biểu diễn dưới dạng R-NH₂ cho amin bậc 1, R2-NH cho amin bậc 2 và R3-N cho amin bậc 3. Trong đó, R có thể đại diện cho một gốc hiđrocacbon, tức là một chuỗi carbon có thể khác nhau.
Cấu trúc của amin không những đơn giản mà còn rất linh hoạt, cho phép chúng tương tác với các hóa chất khác dễ dàng. Chúng có thể tạo thành liên kết hydrogen với nước, làm cho các amin bậc thấp dễ tan trong nước, đặc biệt là trong những trường hợp như metylamin và etylamin. Tuy nhiên, khi số lượng nguyên tử carbon tăng lên, chúng sẽ càng kém tan hơn do ảnh hưởng của lực tương tác.
Cấu tạo của amin
Nhóm chức amin: -NH₂
Bậc của amin: Dựa vào số nguyên tử hydro trong nhóm -NH₂ bị thay thế bởi các nhóm alkyl hoặc aryl, amin được chia thành 3 bậc:
-
Amin bậc một: Có một nhóm alkyl hoặc aryl liên kết với nguyên tử nitơ.
-
Amin bậc hai: Có hai nhóm alkyl hoặc aryl liên kết với nguyên tử nitơ.
-
Amin bậc ba: Có ba nhóm alkyl hoặc aryl liên kết với nguyên tử nitơ.
Tính chất của amin
Tính chất của amin rất đa dạng và có thể chia thành hai nhóm chính: tính chất vật lý và tính chất hóa học. Hiểu rõ về những tính chất này không chỉ giúp cho việc nghiên cứu khoa học mà còn hỗ trợ trong các ứng dụng thực tiễn.
Tính chất vật lý
-
Trạng thái: Các amin bậc thấp như metylamin và etylamin tồn tại chủ yếu ở dạng khí và thường có mùi hôi giống amoniac. Trong khi đó, các amin bậc cao hơn (như hexylamin) có thể tồn tại dưới dạng lỏng hoặc rắn.
-
Độ tan: Các amin bậc thấp tan tốt trong nước do khả năng tạo liên kết hydro với phân tử nước. Tuy nhiên, khi số nguyên tử carbon trong phân tử tăng lên, độ tan của amin sẽ giảm dần.
-
Nhiệt độ sôi: Nhiệt độ sôi của amin thường cao hơn so với các hydrocarbon tương ứng, nhờ vào sự hiện diện của liên kết hydro liên phân tử.
Tính chất hóa học
-
Tính bazơ: Amin có khả năng nhận proton từ axit, vì nhóm amino có thể tạo ra hữu cơ bazơ yếu. Điều này cho phép amin tham gia vào nhiều phản ứng hóa học quan trọng, như phản ứng với axit tạo thành muối.
-
Phản ứng với axit nitrơ: Các amin bậc 1 phản ứng với acid nitrơ tạo ra alkohol và khí N₂. Amin bậc 2 tạo ra nitrosamin, trong khi amin bậc 3 có phản ứng ít hơn với acid nitrơ.
-
Tính nhạy cảm với oxy: Amin không no dễ bị oxy hóa, đặc biệt là trong điều kiện có mặt liên kết pi.
Amin không chỉ là những hợp chất đơn lẻ mà còn là phần không thể thiếu trong nhiều phản ứng sinh hóa, ảnh hưởng đến sức khỏe cũng như các ứng dụng công nghiệp. Sự phong phú của các tính chất này là lý do tại sao amin được xem như một trong những nhóm hợp chất cơ bản của hóa học hữu cơ.
Phân loại amin
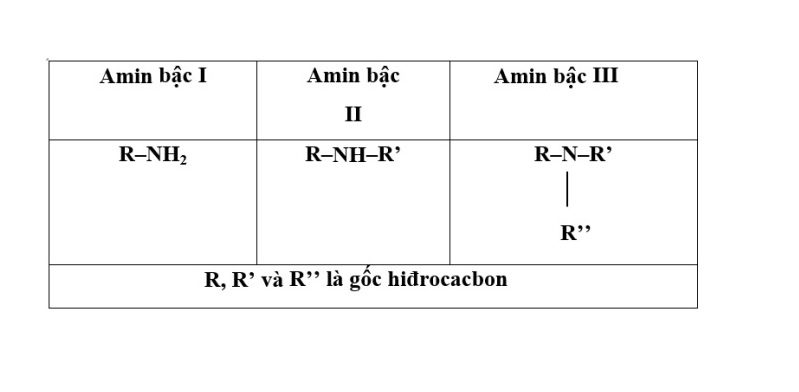
Amin được phân loại dựa trên số nhóm hydro bị thay thế trong phân tử amoniac. Dựa trên tiêu chí này, chúng được chia thành ba loại chính, giúp định hình tính chất và ứng dụng của từng loại amin.
Phân loại amin
Amin bậc 1 (Primary amine)
Đây là loại amin chỉ có một nhóm amino gắn với carbon, trong đó một nguyên tử hydro trong amoniac được thay thế. Ví dụ tiêu biểu cho amin bậc 1 là metylamin (CH₃NH₂). Chúng thường có tính chất bazơ rõ rệt và dễ tham gia vào nhiều phản ứng hóa học.
Amin bậc 2 (Secondary amine)
Khi hai nguyên tử hydro trong amoniac được thay thế, ta có amin bậc 2, điển hình là dimetylamin ((CH₃)₂NH). Những amin này thường ít hơn về tính bazơ so với amin bậc 1, nhưng vẫn có khả năng tham gia các phản ứng hóa học.
Amin bậc 3 (Tertiary amine)
Đối với amin bậc 3, tất cả ba nguyên tử hydro trong amoniac đều bị thay thế. Một ví dụ phổ biến là trimetylamin ((CH₃)₃N). Những amin này thường có tính bazơ yếu hơn và ít tham gia vào phản ứng với acid nitrơ hơn.
Bảng phân loại amin dưới đây tóm tắt các loại amin theo bậc của chúng:
|
Bậc Amin
|
Cấu hình
|
Ví dụ
|
Tính chất hóa học
|
|
Bậc 1
|
R-NH₂
|
Metylamin (CH₃NH₂)
|
Tính bazơ mạnh
|
|
Bậc 2
|
R2-NH
|
Đimetylamin ((CH₃)₂NH)
|
Tính bazơ vừa phải
|
|
Bậc 3
|
R3-N
|
Trimetylamin ((CH₃)₃N)
|
Tính bazơ yếu
|
Vai trò của amin trong sinh học
Amin đóng vai trò vô cùng quan trọng trong sinh học, một lĩnh vực thiết yếu cho mọi sự sống trên hành tinh này. Chúng không chỉ là thành phần cấu tạo nên các phân tử sinh học mà còn tham gia vào nhiều phản ứng sinh hóa phức tạp.
Trước tiên, amin là thành phần chính cấu tạo nên protein thông qua các axit amin. Protein là những phân tử đa chức năng, chịu trách nhiệm cho nhiều hoạt động sinh lý của cơ thể như cung cấp năng lượng, duy trì các chức năng tế bào và tham gia vào cấu tạo các enzym. Điều này có thể ví von rằng amin như những viên gạch xây dựng cho những công trình vĩ đại trong cơ thể.
Ngoài ra, amin cũng đóng vai trò không thể thiếu trong việc sản xuất và điều chỉnh hormone. Hormone điều chỉnh mọi thứ từ sự phát triển, chuyển hóa cho đến chức năng sinh sản. Ví dụ, axit amin tryptophan chính là nguyên liệu ban đầu để tổng hợp serotonin - hormone ảnh hưởng đến tâm trạng và giấc ngủ.
Bên cạnh đó, nhiều axit amin cũng tham gia vào việc hỗ trợ hệ miễn dịch, giúp cơ thể tăng cường sức đề kháng chống lại các mầm bệnh. Một số axit amin như histidine và arginine có khả năng kích thích sản xuất kháng thể, tạo ra “lực lượng” bảo vệ cho cơ thể.
Ứng dụng của amin
Amin không chỉ đứng im trong tự nhiên mà còn thể hiện sức mạnh của chúng thông qua nhiều ứng dụng phong phú trong thực tiễn. Chúng đóng vai trò hết sức quan trọng trong nhiều lĩnh vực như y học, nông nghiệp, công nghiệp thực phẩm và công nghệ sinh học.
Ứng dụng của amin
Trong công nghiệp
-
Sản xuất thuốc nhuộm, thuốc trừ sâu, chất tẩy rửa.
-
Làm chất xúc tác trong nhiều phản ứng hóa học.
-
Sản xuất nhựa, cao su tổng hợp.
Trong y dược
-
Nhiều amin có hoạt tính sinh học, được sử dụng làm thuốc chữa bệnh.
-
Là thành phần của nhiều loại thuốc kháng sinh, thuốc giảm đau.
Trong nông nghiệp
Sự khác biệt giữa amin và ancol
Amin và ancol là hai loại hợp chất hóa học có cấu trúc và tính chất khác nhau, mặc dù cả hai đều thuộc nhóm hợp chất hữu cơ. Sự khác biệt giữa chúng không chỉ nằm ở cách cấu trúc mà còn trong tính chất hóa học và ứng dụng thực tiễn.
Cấu trúc hóa học
-
Amin: Là các hợp chất hữu cơ chứa nhóm amin (-NH₂) gắn với carbon. Chúng có thể hoạt động như một bazơ do khả năng nhận proton.
-
Ancol: Là hợp chất hữu cơ có nhóm hydroxyl (-OH) gắn với carbon. Chúng không chứa nhóm amin, nhưng lại có khả năng tham gia vào phản ứng tạo thành muối với các bazơ.
Tính chất hóa học
-
Amin: Có thể hoạt động như một bazơ yếu vì nhóm amino có khả năng cho đi electron, giúp chúng dễ dàng phản ứng với acid.
-
Ancol: Thường có tính axit yếu do nhóm hydroxyl, điều này khiến chúng dễ dàng tạo thành muối với các bazơ.
Công dụng
-
Amin: Thường được sử dụng trong sản xuất thuốc, hóa chất công nghiệp, chúng cũng là thành phần quan trọng trong các axit amin.
-
Ancol: Được sử dụng rộng rãi trong thực phẩm và đồ uống, trong công nghiệp dược phẩm và hóa chất.
Để dễ hiểu hơn, dưới đây là bảng so sánh cho thấy sự khác biệt giữa amin và ancol:
|
Tiêu chí
|
Amin
|
Ancol
|
|
Cấu trúc hóa học
|
Có nhóm amin (-NH₂)
|
Có nhóm hydroxyl (-OH)
|
|
Tính chất hóa học
|
Làm việc như bazơ yếu
|
Làm việc như axit yếu
|
|
Ứng dụng
|
Sản xuất thuốc, hóa chất
|
Thực phẩm, đồ uống
|
Ví dụ về amin
-
Metylamin (CH₃NH₂): Một amin bậc một, là chất khí có mùi khai, được sử dụng làm dung môi và chất trung gian tổng hợp.
-
Dimetylamin ((CH₃)₂NH): Một amin bậc hai, được sử dụng để sản xuất thuốc trừ sâu, chất làm mềm vải.
-
Anilin (C₆H₅NH₂): Một amin thơm, được sử dụng để sản xuất thuốc nhuộm, nhựa, thuốc nổ.
Qua bài viết này của Đông Á, chúng ta đã khám phá một cách sâu sắc về amin là gì - một nhóm hợp chất hữu cơ rất quan trọng trong lĩnh vực hóa học và sinh học. Từ khái niệm đến cấu tạo, tính chất, phân loại, vai trò trong sinh học cũng như ứng dụng trong cuộc sống, tất cả đều chỉ ra rằng amin không chỉ đơn thuần là những hợp chất đơn lẻ mà còn là nền tảng hỗ trợ cho nhiều khía cạnh của cuộc sống và sức khỏe con người.