Nhôm (Aluminum - Al), một nguyên tố kim loại phổ biến trong tự nhiên, không chỉ có mặt trong cấu trúc của nhiều vật liệu mà còn đóng một vai trò quan trọng trong hóa học. Trong quá trình nghiên cứu và ứng dụng hóa học, số oxi hóa của nhôm – cụ thể là +3 đã trở thành một điểm nổi bật trong các hợp chất mà nhôm tham gia. Bài viết này Đông Á Chemical sẽ đi sâu vào số oxi hóa của nhôm, cách xác định và những ứng dụng phong phú của nó trong thực tế.
Số oxi hóa của nhôm trong các hợp chất hóa học
Nhôm (Al) là một kim loại hoạt động hóa học mạnh và thường có số oxi hóa +3 trong các hợp chất. Đây là số oxi hóa phổ biến và ổn định nhất của nhôm. Tuy nhiên, trong một số điều kiện đặc biệt, nhôm cũng có thể thể hiện các số oxi hóa khác, nhưng rất ít gặp.
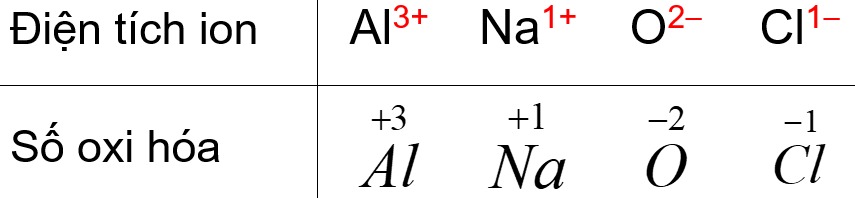
Số oxi hóa của nhôm trong các hợp chất hóa học
Nguyên nhân nhôm thường có số oxi hóa +3:
-
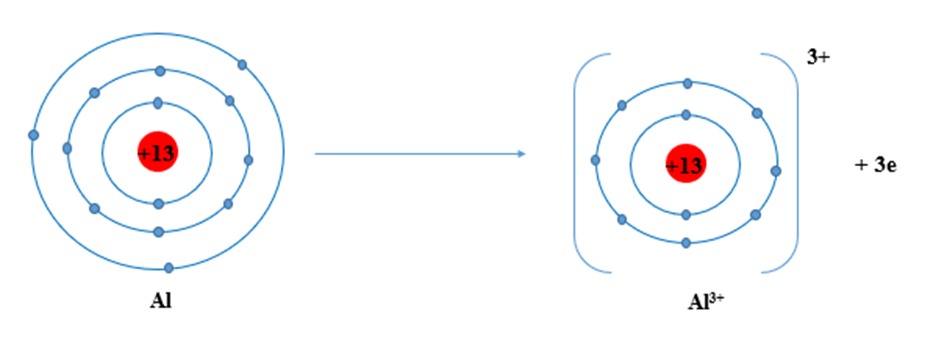
Cấu hình electron: Nhôm có 3 electron ở lớp vỏ ngoài cùng. Để đạt được cấu hình electron bền vững của khí hiếm, nhôm có xu hướng nhường đi 3 electron này.
-
Tính kim loại: Nhôm là kim loại điển hình, có tính khử mạnh. Khi tham gia phản ứng hóa học, nhôm thường nhường electron để tạo thành ion Al³⁺ mang điện tích dương.
Số oxi hóa +3 của nhôm có vai trò gì?
Số oxi hóa +3 của nhôm có vai trò quan trọng trong nhiều lĩnh vực của hóa học, đặc biệt là trong:
-
Xác định công thức hóa học:
-
Dự đoán công thức: Biết số oxi hóa của Al (+3) và của các nguyên tố khác, ta có thể dự đoán công thức hóa học của hợp chất. Ví dụ: Trong Al₂O₃, Al có số oxi hóa +3, O có số oxi hóa -2, nên công thức là Al₂O₃.
-
Kiểm tra công thức: Số oxi hóa giúp kiểm tra lại công thức hóa học có đúng hay không. Tổng số oxi hóa của các nguyên tử trong một phân tử phải bằng 0.
-
Cân bằng phương trình hóa học:
-
Xác định sự thay đổi số oxi hóa: Trong các phản ứng oxi hóa khử, số oxi hóa của các nguyên tố thay đổi. Việc xác định sự thay đổi này giúp cân bằng phương trình.
-
Viết quá trình nhường nhận electron: Số oxi hóa giúp viết các quá trình nhường nhận electron, từ đó cân bằng phương trình.
-
Dự đoán tính chất hóa học:
-
Tính chất của hợp chất: Số oxi hóa giúp dự đoán tính chất hóa học của hợp chất. Ví dụ, các hợp chất của nhôm thường có tính base yếu.
-
Khả năng phản ứng: Số oxi hóa giúp dự đoán khả năng phản ứng của các chất.
-
Xác định vai trò của nguyên tố trong phản ứng:
-
Nghiên cứu cấu tạo phân tử:
Ví dụ minh họa:
Quy tắc xác định số oxi hóa của nhôm
Xác định số oxi hóa của nhôm không đơn giản chỉ là một phép toán, mà còn là một quy trình nghiên cứu và phân tích cụ thể. Để có thể hiểu rõ hơn về số oxi hóa của nhôm, người ta thường áp dụng một số quy tắc căn bản trong hóa học. Các quy tắc này giúp xác định rõ ràng số oxi hóa của nhôm trong các hợp chất và phản ứng hóa học khác nhau.
-
Quy tắc mốc tính: Số oxi hóa của nhôm trong các hợp chất như Al₂O₃ là +3, được tính toán dựa trên số lượng oxi trong hợp chất.
-
Quy tắc vào trị số số oxi hóa của oxy: Với oxy, số oxi hóa luôn là -2. Do đó, trong Al₂O₃, số oxi hóa của nhôm được xác định là +3 bởi phương trình tổng quát: 2Al + 3O → Al₂O₃.
Có thể hiểu, đây là những quy tắc cơ bản mà người nghiên cứu hóa học thường xuyên sử dụng để xác định số oxi hóa của nhôm trong các hợp chất. Để hiểu sâu hơn về số oxi hóa, người ta có thể tham khảo hơn những bài tập cụ thể và nghiên cứu chuyên sâu về tính chất hóa học của nhôm, giúp mở rộng thêm kiến thức và ứng dụng trong thực tiễn.
Tác động của số oxi hóa nhôm trong phản ứng hóa học
Số oxi hóa của nhôm (+3) đóng vai trò quan trọng trong việc xác định tính chất hóa học và khả năng tham gia phản ứng của nhôm. Dưới đây là một số tác động cụ thể:
Tác động của số oxi hóa nhôm trong phản ứng hóa học
1. Xác định tính chất hóa học của hợp chất:
-
Tính base: Các hợp chất của nhôm thường có tính base yếu do sự có mặt của ion Al³⁺. Ví dụ: nhôm hidroxit Al(OH)₃ có tính lưỡng tính.
-
Tính tan: Tính tan của hợp chất nhôm phụ thuộc vào anion kết hợp với ion Al³⁺. Ví dụ: nhôm clorua (AlCl₃) tan tốt trong nước, trong khi nhôm hidroxit (Al(OH)₃) ít tan.
-
Tính bền nhiệt: Các hợp chất của nhôm thường có nhiệt độ nóng chảy và sôi cao do liên kết ion bền vững.
2. Xác định vai trò của nhôm trong phản ứng:
-
Chất khử: Trong một số trường hợp, nhôm có thể đóng vai trò là chất khử, nhường electron để khử các chất khác. Ví dụ: phản ứng nhiệt nhôm.
-
Chất tạo phức: Ion Al³⁺ có khả năng tạo phức với nhiều ion và phân tử khác, tạo thành các hợp chất phức tạp.
3. Ảnh hưởng đến tốc độ phản ứng:
-
Kích thước hạt: Nhôm có kích thước hạt càng nhỏ, diện tích tiếp xúc càng lớn, tốc độ phản ứng càng nhanh.
-
Nhiệt độ: Nâng cao nhiệt độ làm tăng tốc độ phản ứng của nhôm.
-
Chất xúc tác: Một số chất xúc tác có thể làm tăng tốc độ phản ứng của nhôm.
4. Ứng dụng trong công nghiệp:
-
Sản xuất nhôm kim loại: Quá trình điện phân nhôm oxit nóng chảy để sản xuất nhôm kim loại dựa trên việc khử ion Al³⁺ thành nhôm kim loại.
-
Sản xuất hợp kim: Nhôm tạo thành nhiều hợp kim có tính chất cơ học tốt, được sử dụng rộng rãi trong công nghiệp.
-
Chế tạo vật liệu xây dựng: Nhôm và hợp kim nhôm được sử dụng để sản xuất cửa sổ, cửa ra vào, mái nhà,...
-
Sản xuất hóa chất: Nhôm clorua được sử dụng làm chất xúc tác trong nhiều phản ứng hóa học.
Ví dụ minh họa:
-
Phản ứng nhiệt nhôm: 2Al + Fe₂O₃ → Al₂O₃ + 2Fe Trong phản ứng này, nhôm đóng vai trò là chất khử, nhường electron cho sắt.
-
Phản ứng của nhôm với dung dịch axit: 2Al + 6HCl → 2AlCl₃ + 3H₂ Trong phản ứng này, nhôm nhường electron cho ion H⁺ trong axit clohidric.
Ứng dụng thực tiễn của số oxi hóa nhôm
Số oxi hóa của nhôm, đặc biệt là số oxi hóa +3, đóng vai trò vô cùng quan trọng trong việc dự đoán, giải thích và ứng dụng các tính chất hóa học của nhôm và hợp chất của nó. Dưới đây là một số ứng dụng thực tiễn cụ thể:
Ứng dụng thực tiễn của số oxi hóa nhôm
1. Công nghiệp luyện kim:
-
Sản xuất nhôm: Số oxi hóa +3 của nhôm giúp xác định quá trình điện phân nhôm oxit để sản xuất nhôm kim loại.
-
Hợp kim nhôm: Việc hiểu rõ số oxi hóa của nhôm giúp điều chỉnh thành phần hợp kim để đạt được các tính chất mong muốn như độ bền, nhẹ, chống ăn mòn.
2. Công nghiệp hóa chất:
-
Sản xuất hóa chất: Số oxi hóa của nhôm giúp xác định các phản ứng hóa học để sản xuất các hợp chất nhôm như nhôm sunfat, nhôm clorua, được sử dụng rộng rãi trong công nghiệp.
-
Xúc tác: Nhiều hợp chất nhôm có số oxi hóa +3 được sử dụng làm chất xúc tác trong các phản ứng hóa học.
3. Ngành xây dựng:
-
Vật liệu xây dựng: Nhôm và hợp kim nhôm được sử dụng rộng rãi trong xây dựng nhờ tính nhẹ, bền, chống ăn mòn. Số oxi hóa của nhôm giúp hiểu rõ quá trình oxi hóa bề mặt nhôm để tạo thành lớp màng oxit bảo vệ.
-
Betong: Một số hợp chất nhôm được sử dụng làm phụ gia cho bê tông để cải thiện tính chất của bê tông.
4. Ngành công nghiệp điện tử:
-
Linh kiện điện tử: Nhôm được sử dụng để sản xuất các linh kiện điện tử như mạch in, vỏ máy tính, do tính dẫn điện và khả năng tản nhiệt tốt.
-
Pin: Một số hợp chất nhôm được sử dụng làm vật liệu cực trong pin.
5. Ngành xử lý nước:
6. Ngành dược phẩm:
Ví dụ cụ thể:
Sản xuất nhôm: Trong quá trình điện phân nhôm oxit nóng chảy, ion Al³⁺ nhận electron để tạo thành nhôm kim loại: 2Al³⁺ + 6e⁻ → 2Al
Phản ứng nhiệt nhôm: 2Al + Fe₂O₃ → Al₂O₃ + 2Fe
Trong phản ứng này, nhôm nhường electron để khử sắt oxit, số oxi hóa của nhôm tăng từ 0 lên +3.
Qua bài viết trên của Đông Á Chemical có thể thấy số oxi hóa của nhôm là một khái niệm quan trọng giúp chúng ta hiểu rõ hơn về tính chất hóa học của nhôm và các hợp chất của nó. Việc ứng dụng số oxi hóa nhôm vào thực tiễn đã mang lại nhiều lợi ích cho cuộc sống con người.