Bạn có bao giờ tự hỏi tại sao khi đun một nồi nước, nước từ từ nóng hơn? Phản ứng tỏa nhiệt chính là câu trả lời cho hiện tượng này, không chỉ đơn thuần trong việc nấu nướng mà còn xuất hiện trong nhiều quá trình tự nhiên và công nghiệp. Phản ứng này thể hiện sức mạnh của các phản ứng hóa học, khi mà năng lượng dưới dạng nhiệt được giải phóng ra môi trường, tạo nên nhiều ứng dụng thú vị trong cuộc sống hàng ngày. Hãy cùng khám phá xem phản ứng tỏa nhiệt là gì, các đặc điểm nổi bật và vai trò của nó trong thực tiễn.
Khái niệm phản ứng tỏa nhiệt là gì?
Phản ứng tỏa nhiệt là phản ứng hóa học trong đó năng lượng được giải phóng ra môi trường xung quanh, thường dưới dạng nhiệt. Nói cách khác, khi phản ứng xảy ra, hệ thống sẽ mất nhiệt và nhiệt độ của môi trường xung quanh tăng lên.

Khái niệm phản ứng tỏa nhiệt là gì?
Đặc điểm của phản ứng tỏa nhiệt
-
Giải phóng nhiệt: Đặc trưng nổi bật nhất của phản ứng tỏa nhiệt là sự giải phóng nhiệt. Khi phản ứng xảy ra, nhiệt độ của hệ thống và môi trường xung quanh thường tăng lên.
-
Biến thiên enthalpy (ΔH) âm: Enthalpy là một hàm trạng thái biểu thị nhiệt lượng hấp thụ hoặc tỏa ra của một hệ thống ở áp suất không đổi. Đối với phản ứng tỏa nhiệt, ΔH có giá trị âm, tức là hệ thống mất nhiệt.
-
Có thể xảy ra tự phát: Nhiều phản ứng tỏa nhiệt có thể xảy ra tự phát, không cần cung cấp năng lượng từ bên ngoài.
-
Entropy tăng: Phản ứng tỏa nhiệt thường đi kèm với sự tăng entropy (độ hỗn loạn) của hệ thống.
Các loại phản ứng tỏa nhiệt tiêu biểu
-
Phản ứng trung hòa: Phản ứng giữa axit và bazơ tạo thành muối và nước thường là phản ứng tỏa nhiệt.
-
Phản ứng đốt cháy: Phản ứng đốt cháy nhiên liệu (như than, khí đốt, xăng...) trong oxi luôn tỏa ra một lượng nhiệt lớn.
-
Phản ứng oxi hóa kim loại: Nhiều kim loại khi tiếp xúc với oxi sẽ xảy ra phản ứng oxi hóa tỏa nhiệt.
-
Một số phản ứng phân hủy: Không phải tất cả các phản ứng phân hủy đều tỏa nhiệt, nhưng một số loại phản ứng phân hủy lại giải phóng năng lượng dưới dạng nhiệt.
-
Phản ứng kết tủa: Một số phản ứng kết tủa cũng kèm theo sự tỏa nhiệt.
Ví dụ về phản ứng tỏa nhiệt
Ngoài các ví dụ đã nêu trên, còn rất nhiều phản ứng tỏa nhiệt khác xảy ra xung quanh chúng ta. Dưới đây là một số ví dụ khác:
-
Phản ứng của natri với nước: Khi thả một mẩu natri vào nước, sẽ xảy ra phản ứng tỏa nhiệt mạnh, thậm chí có thể gây nổ.
-
Phản ứng của kali permanganat với glycerin: Đây là một phản ứng tỏa nhiệt mạnh, thường được sử dụng trong các thí nghiệm hóa học.
-
Quá trình hô hấp: Quá trình hô hấp tế bào là một loạt các phản ứng hóa học tỏa nhiệt, cung cấp năng lượng cho cơ thể.
Lưu ý: Không phải tất cả các phản ứng hóa học đều là phản ứng tỏa nhiệt. Có một loại phản ứng ngược lại gọi là phản ứng thu nhiệt, trong đó hệ thống hấp thụ nhiệt từ môi trường xung quanh.
Phân biệt phản ứng tỏa nhiệt và phản ứng thu nhiệt
Khi tìm hiểu sâu hơn về phản ứng hóa học, chúng ta không thể không phân biệt giữa phản ứng tỏa nhiệt và phản ứng thu nhiệt. Hai loại phản ứng này có sự khác biệt đáng kể mà chúng ta cần nắm rõ để áp dụng vào các lĩnh vực khác nhau trong cuộc sống.
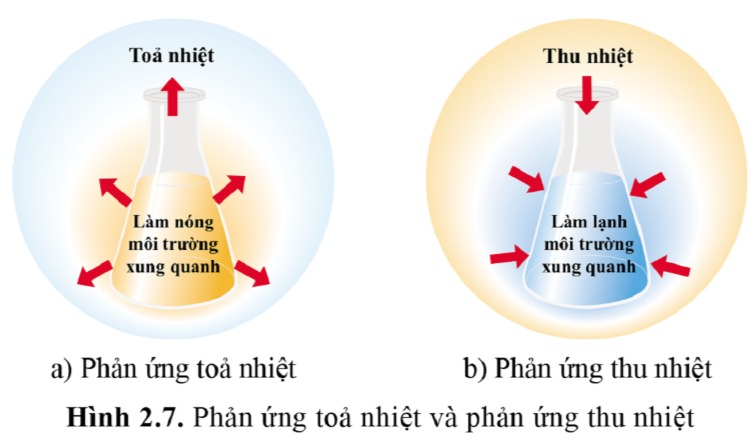
Phân biệt phản ứng tỏa nhiệt và phản ứng thu nhiệt
-
Phản ứng tỏa nhiệt: Như đã giải thích, phản ứng tỏa nhiệt là phản ứng mà năng lượng được giải phóng ra môi trường, chủ yếu là dưới dạng nhiệt. Các sản phẩm có năng lượng thấp hơn so với các chất tham gia, nhiệt độ thường tăng lên trong quá trình xảy ra phản ứng.
-
Phản ứng thu nhiệt: Ngược lại, phản ứng thu nhiệt là những phản ứng trong đó năng lượng được hấp thụ từ môi trường, dẫn đến sự giảm nhiệt độ. Năng lượng cần thiết cho phản ứng này có thể đến từ ánh sáng mặt trời, nhiệt độ môi trường hoặc năng lượng hóa học.
|
Đặc điểm
|
Phản ứng tỏa nhiệt
|
Phản ứng thu nhiệt
|
|
Năng lượng
|
Giải phóng ra ngoài
|
Hấp thụ từ môi trường
|
|
ΔH
|
Âm (ΔH < 0)
|
Dương (ΔH > 0)
|
|
Nhiệt độ
|
Tăng lên
|
Giảm xuống
|
|
Ví dụ
|
Cháy, phản ứng axit-bazơ
|
Tổng hợp, sự tan chảy
|
Ứng dụng của phản ứng tỏa nhiệt trong đời sống
Phản ứng tỏa nhiệt, với khả năng giải phóng nhiệt năng, đóng vai trò quan trọng và rộng rãi trong cuộc sống hàng ngày của chúng ta. Dưới đây là một số ứng dụng điển hình:
1. Sản xuất năng lượng:
-
Đốt cháy nhiên liệu: Đây là ứng dụng phổ biến nhất của phản ứng tỏa nhiệt. Việc đốt cháy các nhiên liệu như than, dầu, khí gas trong các nhà máy nhiệt điện để sản xuất điện năng dựa trên nguyên tắc này.
-
Động cơ đốt trong: Các phương tiện giao thông như ô tô, xe máy sử dụng động cơ đốt trong, nơi nhiên liệu được đốt cháy để tạo ra năng lượng làm quay các bánh xe.
2. Sưởi ấm:

Ứng dụng trong sưởi ấm
-
Sưởi ấm không gian: Hệ thống sưởi trung tâm, lò sưởi, lò hơi đều hoạt động dựa trên nguyên lý đốt cháy nhiên liệu để tạo ra nhiệt.
-
Sưởi ấm nước: Bình nóng lạnh, lò sưởi nước hoạt động bằng cách đốt nóng nước để cung cấp nước nóng cho sinh hoạt.
3. Nấu ăn:
-
Bếp gas, bếp điện: Việc đốt cháy gas hoặc sử dụng điện để tạo ra nhiệt giúp nấu chín thức ăn.
-
Lò nướng: Lò nướng sử dụng nhiệt để nướng, quay các loại thực phẩm.
4. Sản xuất vật liệu:
-
Luyện kim: Quá trình luyện kim để sản xuất kim loại từ quặng cũng liên quan đến các phản ứng tỏa nhiệt.
-
Sản xuất xi măng: Quá nung đá vôi và các nguyên liệu khác để sản xuất clinker là một quá trình tỏa nhiệt.
5. Các ứng dụng khác:
-
Hàn, cắt kim loại: Quá trình hàn, cắt kim loại sử dụng nhiệt lượng để làm nóng chảy kim loại và nối chúng lại với nhau.
-
Phản ứng hóa học trong phòng thí nghiệm: Nhiều phản ứng hóa học tỏa nhiệt được sử dụng trong các thí nghiệm để cung cấp nhiệt hoặc tạo ra các sản phẩm mới.
-
Túi sưởi hóa học: Túi sưởi chứa các chất có khả năng phản ứng tỏa nhiệt khi tiếp xúc với nước hoặc không khí.
Cách nhận biết phản ứng tỏa nhiệt trong hóa học
Phản ứng tỏa nhiệt là phản ứng hóa học giải phóng năng lượng ra môi trường xung quanh, thường dưới dạng nhiệt. Để nhận biết một phản ứng có phải là phản ứng tỏa nhiệt hay không, chúng ta có thể dựa vào các dấu hiệu sau:

Cách nhận biết phản ứng tỏa nhiệt trong hóa học
1. Tăng nhiệt độ:
-
Dấu hiệu trực quan: Khi phản ứng xảy ra, nếu nhiệt độ của dung dịch hoặc môi trường xung quanh tăng lên, rất có thể đó là phản ứng tỏa nhiệt.
-
Dụng cụ hỗ trợ: Sử dụng nhiệt kế để đo nhiệt độ trước và sau phản ứng. Nếu nhiệt độ tăng, phản ứng là tỏa nhiệt.
2. Có sự phát sáng:
-
Ngọn lửa: Nhiều phản ứng tỏa nhiệt đi kèm với sự xuất hiện ngọn lửa, ví dụ như đốt cháy nhiên liệu.
-
Ánh sáng: Một số phản ứng tỏa nhiệt có thể phát ra ánh sáng yếu, đặc biệt là trong điều kiện tối.
3. Có sự phát ra âm thanh:
4. Có sự tạo thành chất khí:
5. Biến thiên enthalpy (ΔH):
Các yếu tố ảnh hưởng tới phản ứng tỏa nhiệt
Phản ứng tỏa nhiệt là một quá trình hóa học giải phóng năng lượng dưới dạng nhiệt. Nhiều yếu tố có thể ảnh hưởng đến tốc độ và mức độ tỏa nhiệt của một phản ứng. Dưới đây là một số yếu tố chính:
1. Bản chất của chất phản ứng:
-
Cấu trúc phân tử: Cấu trúc phân tử của chất phản ứng ảnh hưởng đến khả năng hình thành liên kết mới và phá vỡ liên kết cũ. Các chất có cấu trúc phức tạp thường có phản ứng chậm hơn.
-
Tính hoạt động hóa học: Các chất có tính hoạt động hóa học cao thường tham gia phản ứng nhanh hơn và tỏa nhiệt nhiều hơn.
2. Nồng độ:
3. Nhiệt độ:
4. Áp suất:
-
Đối với chất khí: Tăng áp suất làm tăng nồng độ của chất khí, dẫn đến tăng tốc độ phản ứng.
-
Đối với chất lỏng và chất rắn: Áp suất ít ảnh hưởng đến tốc độ phản ứng.
5. Diện tích bề mặt tiếp xúc:
6. Chất xúc tác:
7. Dung môi:
8. Ánh sáng:
Các yếu tố khác:
-
Sự khuấy trộn: Khuấy trộn đều hỗn hợp phản ứng giúp tăng tốc độ tiếp xúc giữa các phân tử.
-
Lượng nhiệt tỏa ra: Mỗi phản ứng tỏa nhiệt có một lượng nhiệt tỏa ra đặc trưng, phụ thuộc vào bản chất của chất phản ứng.
Phản ứng tỏa nhiệt không chỉ là một khái niệm hóa học đơn giản mà còn là một phần thiết yếu trong nhiều lĩnh vực của đời sống. Từ việc nấu nướng hàng ngày cho đến việc sản xuất năng lượng, các phản ứng này đóng vai trò quan trọng trong việc cung cấp nhiệt và năng lượng cần thiết để duy trì các hoạt động của con người. Qua bài viết này, chúng ta đã cùng nhau khám phá nhiều khía cạnh khác nhau của phản ứng tỏa nhiệt là gì, đặc điểm, ứng dụng và cách nhận diện cho đến các yếu tố ảnh hưởng. Dongachem.vn hy vọng rằng những kiến thức này sẽ giúp bạn hiểu rõ hơn về phản ứng tỏa nhiệt và ứng dụng của nó trong thực tế.