Chất phản ứng là một khái niệm quan trọng trong hóa học, đặc biệt liên quan đến cách mà các chất tương tác và biến đổi trong quá trình tạo ra sản phẩm mới. Khi nhắc đến chất phản ứng, chúng ta đang đề cập đến những nguyên liệu cần thiết để bắt đầu một phản ứng hóa học. Từ những đơn chất đơn giản cho đến các hợp chất phức tạp, chất phản ứng không chỉ là thành phần chính mà còn đóng vai trò quyết định trong tính chất và kết quả cuối cùng của phản ứng đó. Bài viết này dongachem.vn sẽ giúp bạn hiểu rõ hơn về định nghĩa chất phản ứng là gì, đặc điểm, vai trò và nhiều khía cạnh khác liên quan đến chất phản ứng trong hóa học.
Định nghĩa chất phản ứng là gì?
Chất phản ứng là các chất ban đầu tham gia vào một phản ứng hóa học. Chúng là những "nguyên liệu" mà khi kết hợp với nhau dưới những điều kiện nhất định sẽ tạo ra các chất mới, gọi là sản phẩm.

Định nghĩa chất phản ứng là gì?
Hình dung chất phản ứng
Bạn có thể hình dung chất phản ứng như những khối lego. Các khối lego này (chất phản ứng) khi kết hợp với nhau theo một cách nhất định sẽ tạo ra một mô hình hoàn toàn mới (sản phẩm).
Đặc điểm của chất phản ứng
-
Biến đổi: Trong quá trình phản ứng, chất phản ứng sẽ bị biến đổi về cấu trúc và thành phần để tạo ra sản phẩm mới.
-
Giảm dần: Lượng chất phản ứng sẽ giảm dần theo thời gian khi phản ứng diễn ra.
-
Tham gia trực tiếp: Chất phản ứng tham gia trực tiếp vào quá trình phá vỡ và hình thành liên kết hóa học.
Ví dụ:
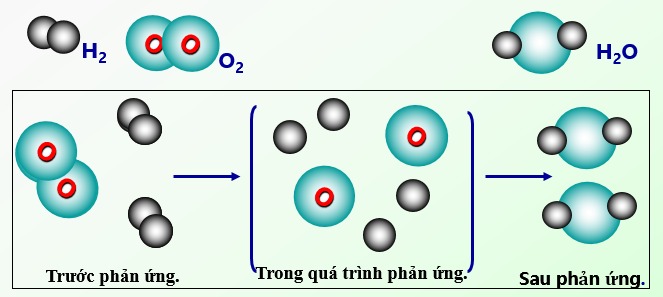
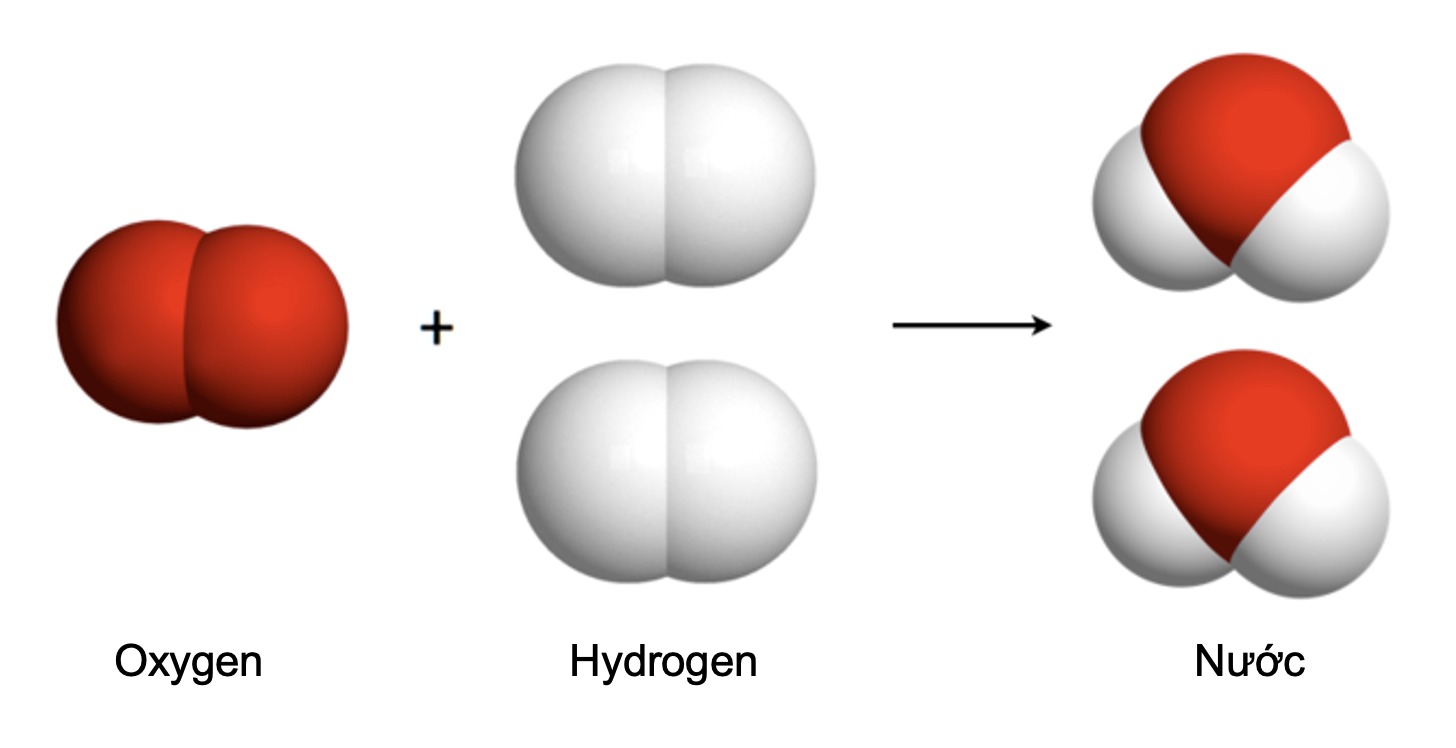
Trong phản ứng đốt cháy metan:
CH₄ + 2O₂ → CO₂ + 2H₂O
Vai trò của chất phản ứng trong các phản ứng hóa học
Chất phản ứng là những "nguyên liệu" ban đầu tham gia vào một phản ứng hóa học. Chúng là những chất bị biến đổi thành các chất mới, gọi là sản phẩm. Vai trò chính của chất phản ứng:
-
Cung cấp nguyên liệu: Chất phản ứng cung cấp các nguyên tử, phân tử hoặc ion cần thiết để tạo thành các sản phẩm mới.
-
Tham gia vào quá trình biến đổi: Chất phản ứng trực tiếp tham gia vào quá trình phá vỡ và hình thành liên kết hóa học, dẫn đến sự thay đổi về cấu trúc và thành phần của chất.
-
Quyết định sản phẩm tạo thành: Loại chất phản ứng và tỉ lệ mol của chúng sẽ quyết định loại sản phẩm và lượng sản phẩm tạo thành.
Bạn có thể hình dung quá trình phản ứng hóa học như một công thức nấu ăn. Chất phản ứng là các nguyên liệu (bột, trứng, đường...), còn sản phẩm là món ăn cuối cùng (bánh, bánh quy...). Để tạo ra một món ăn ngon, chúng ta cần có đủ nguyên liệu và thực hiện đúng các bước nấu ăn. Tương tự như vậy, để tạo ra một sản phẩm hóa học, chúng ta cần có đủ chất phản ứng và thực hiện phản ứng trong điều kiện thích hợp.
Phân loại chất phản ứng
Chất phản ứng là những chất ban đầu tham gia vào một phản ứng hóa học. Chúng có thể được phân loại dựa trên nhiều tiêu chí khác nhau, bao gồm:
Có thể chia chất phản ứng ra nhiều loại khác nhau
1. Dựa vào vai trò trong phản ứng:
-
Chất oxi hóa: Là chất nhận electron, có số oxi hóa giảm trong phản ứng.
-
Chất khử: Là chất nhường electron, có số oxi hóa tăng trong phản ứng.
-
Axit: Là chất cho proton (H⁺).
-
Bazơ: Là chất nhận proton (H⁺).
-
Muối: Là hợp chất ion tạo thành từ cation kim loại hoặc amoni và anion gốc axit.
2. Dựa vào tính chất:
-
Chất hữu cơ: Là hợp chất của carbon (trừ một số đơn chất của carbon, các oxit của carbon, các muối cacbonat và các muối xianua).
-
Chất vô cơ: Là hợp chất không phải chất hữu cơ.
3. Dựa vào trạng thái:
-
Chất khí: Các chất ở thể khí ở điều kiện thường.
-
Chất lỏng: Các chất ở thể lỏng ở điều kiện thường.
-
Chất rắn: Các chất ở thể rắn ở điều kiện thường.
4. Dựa vào tính tan:
5. Dựa vào tính độc:
Các yếu tố ảnh hưởng đến chất phản ứng trong phản ứng hóa học
Khi tham gia vào một phản ứng hóa học, chất phản ứng sẽ trải qua những biến đổi để tạo thành sản phẩm mới. Tuy nhiên, bản chất và tốc độ của những biến đổi này không chỉ phụ thuộc vào bản chất của chất phản ứng mà còn chịu ảnh hưởng bởi nhiều yếu tố khác nhau.
Các yếu tố ảnh hưởng đến chất phản ứng trong phản ứng hóa học
1. Bản chất của chất phản ứng:
-
Tính chất hóa học: Mỗi chất có tính chất hóa học riêng biệt, quyết định khả năng tham gia vào các loại phản ứng khác nhau và tốc độ phản ứng. Ví dụ: kim loại kiềm thường phản ứng mạnh với nước, trong khi kim loại quý như vàng lại rất trơ.
-
Cấu trúc phân tử: Cấu trúc phân tử của chất phản ứng ảnh hưởng đến khả năng tiếp xúc và tương tác giữa các phân tử, từ đó ảnh hưởng đến tốc độ phản ứng.
2. Điều kiện phản ứng:
-
Nồng độ: Nồng độ chất phản ứng càng cao, khả năng va chạm giữa các phân tử càng lớn, dẫn đến tốc độ phản ứng tăng lên.
-
Nhiệt độ: Nâng cao nhiệt độ làm tăng năng lượng động của các phân tử, khiến chúng di chuyển nhanh hơn và va chạm mạnh hơn, từ đó tăng tốc độ phản ứng.
-
Áp suất: Đối với các phản ứng có chất khí tham gia, tăng áp suất sẽ làm tăng nồng độ của chất khí, dẫn đến tăng tốc độ phản ứng.
-
Dung môi: Dung môi có thể làm tăng hoặc giảm tốc độ phản ứng bằng cách hòa tan chất phản ứng, tạo điều kiện thuận lợi hoặc cản trở quá trình tiếp xúc giữa các phân tử.
-
Chất xúc tác: Chất xúc tác làm tăng tốc độ phản ứng bằng cách cung cấp một con đường phản ứng mới có năng lượng hoạt hóa thấp hơn.
-
Diện tích bề mặt: Đối với chất rắn, tăng diện tích bề mặt tiếp xúc sẽ làm tăng tốc độ phản ứng.
3. Các yếu tố khác:
-
Ánh sáng: Một số phản ứng hóa học cần ánh sáng để khởi động.
-
Điện trường: Điện trường có thể ảnh hưởng đến tốc độ và hướng của các ion trong dung dịch, từ đó ảnh hưởng đến tốc độ phản ứng.
-
Âm thanh: Một số nghiên cứu cho thấy âm thanh có tần số cao có thể ảnh hưởng đến tốc độ của một số phản ứng hóa học nhất định.
Ví dụ minh họa:
-
Phản ứng giữa kẽm và axit clohidric: Khi tăng nồng độ axit hoặc tăng nhiệt độ, phản ứng sẽ xảy ra nhanh hơn.
-
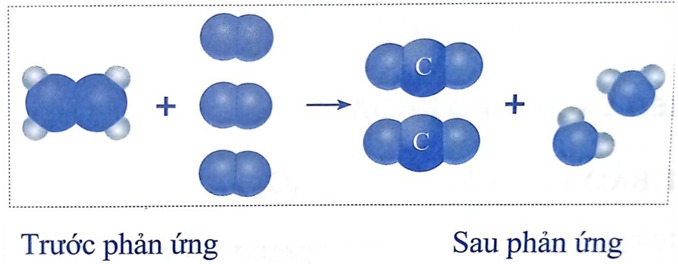
Phản ứng đốt cháy: Khi tăng lượng oxi cung cấp, tốc độ cháy sẽ tăng lên.
-
Sản xuất amoniac: Quá trình sản xuất amoniac từ nitơ và hydro sử dụng chất xúc tác sắt để tăng tốc độ phản ứng.
Chất phản ứng dư là gì?
Chất phản ứng dư là chất tham gia vào phản ứng hóa học mà sau khi phản ứng kết thúc, một phần của nó vẫn còn lại, không tham gia vào phản ứng nữa.
Hình dung chất phản ứng dư
Để hiểu rõ hơn về chất phản ứng dư, chúng ta có thể ví von quá trình phản ứng hóa học như một bữa tiệc.
- Chất phản ứng: Là các loại thực phẩm được chuẩn bị cho bữa tiệc (ví dụ: thịt, rau, gạo).
- Sản phẩm: Là món ăn được tạo ra từ các nguyên liệu đó (ví dụ: cơm, canh, rau xào).
- Chất phản ứng dư: Là lượng thức ăn còn thừa sau khi bữa tiệc kết thúc.
Trong phản ứng hóa học, cũng tương tự như vậy. Nếu một trong các chất phản ứng có lượng nhiều hơn so với lượng cần thiết để phản ứng hết với các chất còn lại, thì chất đó sẽ còn dư sau khi phản ứng kết thúc.
Tại sao có chất phản ứng dư?
Có nhiều lý do dẫn đến việc xuất hiện chất phản ứng dư:
- Tỉ lệ mol của các chất không đúng: Nếu một chất có số mol lớn hơn so với tỉ lệ mol theo phương trình hóa học, thì chất đó sẽ dư.
- Một trong các chất phản ứng không tan hết: Nếu một chất phản ứng không tan hết trong dung dịch, thì chỉ có phần chất tan mới tham gia phản ứng, phần còn lại sẽ ở dạng rắn và dư.
- Có chất xúc tác: Chất xúc tác làm tăng tốc độ phản ứng nhưng không bị tiêu hao trong quá trình phản ứng, do đó nó vẫn còn dư sau khi phản ứng kết thúc.
Cách xác định chất phản ứng dư
Để xác định chất phản ứng dư, ta thường thực hiện các bước sau:
- Viết phương trình hóa học cân bằng.
- Tính số mol của các chất tham gia phản ứng.
- So sánh tỉ lệ số mol thực tế với tỉ lệ số mol theo phương trình hóa học.
- Xác định chất phản ứng hết và chất phản ứng dư.
Ứng dụng của chất phản ứng dư
Việc có chất phản ứng dư đôi khi được ứng dụng trong công nghiệp để:
- Tăng hiệu suất phản ứng: Bằng cách cho dư một chất, ta có thể đẩy nhanh quá trình phản ứng và tăng lượng sản phẩm thu được.
- Bảo vệ thiết bị: Trong một số trường hợp, chất dư có thể giúp bảo vệ thiết bị phản ứng khỏi bị ăn mòn.
Tóm lại, chất phản ứng dư là một khái niệm quan trọng trong hóa học. Việc hiểu rõ về chất phản ứng dư giúp chúng ta giải quyết các bài toán hóa học một cách chính xác và hiệu quả hơn.
Sự khác biệt giữa chất phản ứng và sản phẩm
Trong một phản ứng hóa học, ta thường gặp hai khái niệm chính: chất phản ứng và sản phẩm. Dưới đây là sự khác biệt cơ bản giữa hai loại chất này:
Sự khác biệt giữa chất phản ứng và sản phẩm
Chất phản ứng
-
Định nghĩa: Là những chất ban đầu tham gia vào phản ứng hóa học.
-
Vai trò: Bị biến đổi thành chất mới trong quá trình phản ứng.
-
Thay đổi: Lượng chất phản ứng giảm dần theo thời gian khi phản ứng diễn ra.
-
Ví dụ: Trong phản ứng đốt cháy metan: CH₄ + 2O₂ → CO₂ + 2H₂O, metan (CH₄) và oxi (O₂) là chất phản ứng.
Sản phẩm
-
Định nghĩa: Là những chất mới được tạo thành sau khi phản ứng hóa học xảy ra.
-
Vai trò: Là kết quả của quá trình biến đổi từ chất phản ứng.
-
Thay đổi: Lượng sản phẩm tăng dần theo thời gian khi phản ứng diễn ra.
-
Ví dụ: Tiếp tục với phản ứng trên, carbon dioxide (CO₂) và hơi nước (H₂O) là sản phẩm.
Bảng so sánh chi tiết:
|
Đặc điểm
|
Chất phản ứng
|
Sản phẩm
|
|
Thời điểm xuất hiện
|
Trước phản ứng
|
Sau phản ứng
|
|
Biến đổi
|
Bị biến đổi
|
Được tạo thành
|
|
Lượng chất
|
Giảm dần
|
Tăng dần
|
|
Vai trò
|
Tham gia phản ứng
|
Là kết quả của phản ứng
|
Qua bài viết trên có thể thấy chất phản ứng giữ vai trò quan trọng trong hóa học, không chỉ vì chúng là những nguyên liệu cần thiết để tạo ra sản phẩm mới mà còn vì chúng ảnh hưởng mạnh mẽ đến tốc độ, cơ chế và kết quả cuối cùng của phản ứng. Từ việc hiểu rõ chất phản ứng là gì, các đặc điểm, phân loại, vai trò cho đến những yếu tố tác động đến chúng, ta có thể thấy rằng chất phản ứng thực sự là những phần không thể thiếu trong cuộc sống hàng ngày, từ những bữa ăn đơn giản cho đến các quy trình sản xuất phức tạp trong ngành công nghiệp. Dongachem.vn hi vọng rằng việc nắm bắt được kiến thức về chất phản ứng sẽ giúp chúng ta có cái nhìn sâu sắc hơn về thế giới hóa học xung quanh.