Phản ứng thế là một trong những khái niệm quan trọng và cơ bản trong hóa học. Đây là loại phản ứng hóa học xảy ra khi một nguyên tử hoặc nhóm nguyên tử trong một hợp chất được thay thế bởi một nguyên tử hoặc nhóm nguyên tử khác. Hình thức này không chỉ diễn ra trong hóa học hữu cơ mà còn rất phổ biến trong hóa học vô cơ, với rất nhiều ứng dụng trong thực tế. Bài viết này hóa chất Đông Á sẽ giúp bạn hiểu rõ bản chất phản ứng thế là gì cũng như đặc điểm, ứng dụng của phản ứng này.
Định nghĩa phản ứng thế là gì?
Phản ứng thế là một loại phản ứng hóa học trong đó một nguyên tử, ion hoặc nhóm nguyên tử trong một phân tử được thay thế bằng một nguyên tử, ion hoặc nhóm nguyên tử khác.
Định nghĩa phản ứng thế là gì?
Đặc điểm chính
-
Sự thay thế: Đây là đặc điểm cơ bản nhất. Một phần tử trong phân tử gốc bị "đẩy ra" và thay thế bằng một phần tử khác.
-
Tạo thành chất mới: Phản ứng thế luôn tạo ra ít nhất một chất mới.
-
Bảo toàn khối lượng: Tổng khối lượng của các chất tham gia phản ứng bằng tổng khối lượng của các chất sản phẩm.
-
Có thể xảy ra trong nhiều môi trường: Phản ứng thế có thể xảy ra trong dung dịch, pha khí hoặc thậm chí trong chất rắn.
Các loại phản ứng thế
1. Phản ứng thế đơn giản:
2. Phản ứng thế halogen:
3. Phản ứng thế nhóm hydroxyl:
4. Phản ứng thế nitro:
5. Phản ứng thế nhóm amino:
Cơ chế phản ứng thế
Cơ chế phản ứng thế phụ thuộc vào nhiều yếu tố như:
-
Tính chất của chất tham gia: Bản chất của liên kết hóa học, độ âm điện của nguyên tử.
-
Điều kiện phản ứng: Nhiệt độ, áp suất, chất xúc tác.
-
Cấu trúc phân tử: Vị trí của liên kết, hiệu ứng không gian.
Cơ chế chung của phản ứng thế:
-
Giai đoạn tấn công: Chất tấn công (nucleophile hoặc electrophile) tiếp cận trung tâm phản ứng của phân tử.
-
Giai đoạn tạo phức trung gian: Tạo thành một phức trung gian không bền.
-
Giai đoạn tách: Phân tử trung gian tách ra tạo thành sản phẩm.
Ví dụ về phản ứng thế điển hình
Để mang lại cái nhìn sâu sắc hơn về phản ứng thế, hãy cùng xem xét các ví dụ điển hình.
Phản ứng thế ankan
Phản ứng thế ankan là một loại phản ứng thế đặc trưng, trong đó một nguyên tử hydro trong phân tử ankan bị thay thế bởi một nguyên tử hoặc nhóm nguyên tử khác. Phản ứng này thường xảy ra dưới tác dụng của ánh sáng hoặc nhiệt độ cao.
Ví dụ điển hình: Phản ứng thế của metan với clo
Đặc điểm của phản ứng thế ankan:
-
Dễ dàng xảy ra: Các liên kết C-H trong ankan tương đối yếu, dễ bị phá vỡ.
-
Tạo ra hỗn hợp sản phẩm: Phản ứng thường tạo ra hỗn hợp các sản phẩm thế mono, di, tri...
-
Ảnh hưởng của điều kiện: Ánh sáng, nhiệt độ, tỉ lệ mol các chất tham gia ảnh hưởng đến tốc độ và thành phần sản phẩm của phản ứng.
Phản ứng thế halogen
Phản ứng thế halogen là một loại phản ứng thế đặc biệt, trong đó nguyên tử halogen trong hợp chất hữu cơ bị thay thế bởi một nguyên tử hoặc nhóm nguyên tử khác.
Ví dụ điển hình: Phản ứng thế của alkyl halide với nhóm hydroxyl
-
Phương trình phản ứng: R-X + NaOH → R-OH + NaX (R là gốc alkyl, X là halogen)
-
Cơ chế phản ứng: Phản ứng này thường xảy ra theo cơ chế SN2 (Substitution Nucleophilic Bimolecular), trong đó nhóm hydroxyl tấn công vào nguyên tử cacbon mang halogen từ phía đối diện với nhóm halogen, dẫn đến sự đảo ngược cấu hình.
Đặc điểm của phản ứng thế halogen:
-
Tính chất của halogen: Halogen càng mạnh thì phản ứng càng dễ xảy ra.
-
Tính chất của gốc alkyl: Gốc alkyl càng cồng kềnh thì phản ứng càng khó xảy ra.
-
Điều kiện phản ứng: Dung môi, nhiệt độ, nồng độ chất tham gia ảnh hưởng đến tốc độ phản ứng.
Phản ứng thế ái nhân
Phản ứng thế ái nhân là một loại phản ứng thế trong đó một cặp electron giàu điện tử (nucleophile) tấn công vào một nguyên tử có độ âm điện cao (electrophile) trong phân tử, dẫn đến sự thay thế một nhóm nguyên tử hoặc ion.
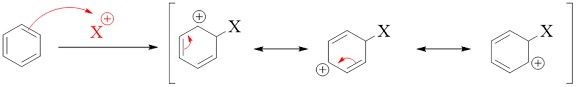
Minh họa cho phản ứng thế ái nhân
Ví dụ điển hình: Phản ứng thế ái nhân của alkyl halide với ion hydroxide
-
Phương trình phản ứng: R-X + OH⁻ → R-OH + X⁻
-
Cơ chế phản ứng: Tương tự như phản ứng thế halogen, phản ứng này cũng có thể xảy ra theo cơ chế SN2.
Đặc điểm của phản ứng thế ái nhân:
-
Tính chất của nucleophile: Nucleophile càng mạnh thì phản ứng càng dễ xảy ra.
-
Tính chất của electrophile: Electrophile càng yếu thì phản ứng càng dễ xảy ra.
-
Điều kiện phản ứng: Dung môi, nhiệt độ, nồng độ chất tham gia ảnh hưởng đến tốc độ phản ứng.
Lưu ý:
Các yếu tố ảnh hưởng tới phản ứng thế
Phản ứng thế là một loại phản ứng hóa học phổ biến, trong đó một nguyên tử, ion hoặc nhóm nguyên tử trong một phân tử được thay thế bằng một nguyên tử, ion hoặc nhóm nguyên tử khác. Tốc độ và hiệu suất của phản ứng thế phụ thuộc vào nhiều yếu tố khác nhau.
1. Bản chất của chất tham gia:
-
Tính chất của nguyên tử bị thế: Nguyên tử có độ âm điện lớn hơn, liên kết yếu hơn sẽ dễ bị thay thế hơn.
-
Tính chất của nhóm thế: Nhóm thế càng mạnh (nucleophile hoặc electrophile mạnh) thì phản ứng càng dễ xảy ra.
-
Cấu trúc phân tử: Cấu trúc không gian của phân tử ảnh hưởng đến khả năng tiếp cận của nhóm thế vào trung tâm phản ứng.
2. Điều kiện phản ứng:
-
Dung môi: Dung môi phân cực có thể tăng tốc độ phản ứng thế ái nhân, trong khi dung môi không phân cực lại thuận lợi cho phản ứng thế gốc tự do.
-
Nhiệt độ: Nâng cao nhiệt độ làm tăng tốc độ phản ứng bằng cách tăng năng lượng hoạt hóa của các phân tử.
-
Áp suất: Đối với phản ứng có chất khí tham gia, tăng áp suất sẽ làm tăng nồng độ chất khí, từ đó tăng tốc độ phản ứng.
-
Chất xúc tác: Chất xúc tác làm giảm năng lượng hoạt hóa của phản ứng, giúp phản ứng xảy ra nhanh hơn.
-
Ánh sáng: Một số phản ứng thế, đặc biệt là phản ứng thế gốc tự do, cần ánh sáng để khởi đầu.
3. Cơ chế phản ứng:
-
Cơ chế SN1: Phản ứng thế đơn phân tử, xảy ra qua một trung gian cacbocation.
-
Cơ chế SN2: Phản ứng thế lưỡng phân tử, xảy ra một bước duy nhất.
-
Cơ chế gốc tự do: Phản ứng xảy ra qua các gốc tự do.
4. Các yếu tố khác:
-
Nồng độ: Tăng nồng độ chất tham gia làm tăng tần suất va chạm giữa các phân tử, từ đó tăng tốc độ phản ứng.
-
Diện tích bề mặt: Đối với phản ứng xảy ra ở bề mặt, tăng diện tích bề mặt tiếp xúc sẽ làm tăng tốc độ phản ứng.
Ví dụ:
-
Phản ứng thế của metan với clo: Ánh sáng, nhiệt độ, tỉ lệ mol các chất tham gia ảnh hưởng đến tốc độ và thành phần sản phẩm của phản ứng.
-
Phản ứng thế của alkyl halide với nhóm hydroxyl: Dung môi phân cực (như nước) thuận lợi cho phản ứng này.
-
Phản ứng thế ái nhân thơm: Tính chất của nhóm thế trên vòng benzen ảnh hưởng đến vị trí và tốc độ của phản ứng.
Ứng dụng của phản ứng thế
Phản ứng thế là một trong những loại phản ứng hóa học cơ bản và phổ biến nhất, nó đóng vai trò quan trọng trong nhiều lĩnh vực của cuộc sống. Dưới đây là một số ứng dụng điển hình của phản ứng thế:

Phản ứng thế có nhiều ứng dụng trong cuộc sống
1. Tổng hợp hữu cơ:
-
Điều chế các hợp chất hữu cơ: Phản ứng thế là một trong những công cụ chính để xây dựng các phân tử hữu cơ phức tạp từ các phân tử đơn giản hơn. Ví dụ:
-
Chuyển hóa nhóm chức: Phản ứng thế giúp chuyển đổi một nhóm chức này thành nhóm chức khác, tạo ra các hợp chất có tính chất khác nhau.
2. Công nghiệp hóa chất:
-
Sản xuất nhựa: Nhiều loại nhựa được sản xuất thông qua các phản ứng thế, ví dụ như phản ứng trùng hợp và trùng ngưng.
-
Sản xuất thuốc: Phản ứng thế được sử dụng để tổng hợp các hoạt chất dược phẩm.
-
Sản xuất phẩm nhuộm: Các hợp chất hữu cơ có màu sắc thường được điều chế bằng các phản ứng thế.
3. Sinh học:
-
Quá trình trao đổi chất: Nhiều phản ứng sinh hóa trong cơ thể là các phản ứng thế, ví dụ như quá trình phosphoryl hóa.
-
Tổng hợp protein: Quá trình tổng hợp protein liên quan đến việc thay thế các nucleotide trong chuỗi mRNA bằng các amino acid tương ứng.
4. Môi trường:
-
Xử lý nước thải: Các phản ứng thế được sử dụng để loại bỏ các chất ô nhiễm trong nước thải.
-
Sản xuất nhiên liệu sinh học: Quá trình chuyển hóa các chất béo và dầu thực vật thành nhiên liệu sinh học cũng liên quan đến các phản ứng thế.
5. Ngành công nghiệp thực phẩm:
Ví dụ cụ thể:
-
Sản xuất xà phòng: Quá trình xà phòng hóa là một phản ứng thế, trong đó các este trong chất béo bị thủy phân bởi kiềm tạo thành muối của axit béo (xà phòng) và glycerol.
-
Sản xuất thuốc aspirin: Aspirin được tổng hợp từ axit salicylic qua phản ứng thế với anhydrit acetic.
So sánh phản ứng thế và các loại phản ứng khác
Phản ứng thế là một trong những loại phản ứng hóa học cơ bản, nhưng để hiểu rõ hơn về nó, chúng ta cần so sánh nó với các loại phản ứng khác.Dưới đây là bảng so sánh chi tiết:
|
Đặc điểm
|
Phản ứng thế
|
Phản ứng hóa hợp
|
Phản ứng phân hủy
|
Phản ứng trao đổi
|
Phản ứng oxi hóa khử
|
|
Định nghĩa
|
Một nguyên tử, ion hoặc nhóm nguyên tử trong một phân tử được thay thế bởi một nguyên tử, ion hoặc nhóm nguyên tử khác.
|
Hai hay nhiều chất kết hợp với nhau tạo thành một chất mới.
|
Một chất phân hủy thành hai hay nhiều chất mới.
|
Các chất trao đổi với nhau thành phần cấu tạo.
|
Có sự thay đổi số oxi hóa của các nguyên tố.
|
|
Ví dụ
|
Fe + CuSO₄ → FeSO₄ + Cu
|
2Mg + O₂ → 2MgO
|
2KClO₃ → 2KCl + 3O₂
|
AgNO₃ + NaCl → AgCl↓ + NaNO₃
|
2Fe + 3Cl₂ → 2FeCl₃
|
|
Đặc trưng
|
Thay thế
|
Kết hợp
|
Phân tách
|
Trao đổi
|
Thay đổi số oxi hóa
|
-
Phản ứng thế và phản ứng hóa hợp: Cả hai đều tạo ra chất mới, nhưng phản ứng thế có sự thay thế, còn phản ứng hóa hợp có sự kết hợp.
-
Phản ứng thế và phản ứng phân hủy: Phản ứng thế có sự thay thế, còn phản ứng phân hủy có sự phân tách.
-
Phản ứng thế và phản ứng trao đổi: Cả hai đều có sự trao đổi thành phần, nhưng phản ứng thế thường chỉ liên quan đến một phần của phân tử, còn phản ứng trao đổi có thể liên quan đến nhiều phần tử.
-
Phản ứng thế và phản ứng oxi hóa khử: Không phải tất cả các phản ứng thế đều là phản ứng oxi hóa khử, nhưng một số phản ứng thế có thể kèm theo sự thay đổi số oxi hóa.
Mặc dù có sự khác biệt, nhưng các loại phản ứng hóa học đều có mối liên hệ với nhau. Việc phân loại các phản ứng giúp chúng ta hiểu rõ hơn về quá trình biến đổi chất và ứng dụng chúng vào thực tế.
Qua bài viết trên của hóa chất Đông Á có thể thấy với những đặc điểm nổi bật như sự thay đổi số oxi hóa, dạng phân loại đa dạng, cơ chế thực hiện phức tạp, phản ứng thế chạm đến nhiều lĩnh vực như dược phẩm, công nghệ thực phẩm và nghiên cứu môi trường. Việc hiểu rõ về phản ứng thế là gì không chỉ nâng cao kiến thức hóa học mà còn lan tỏa khả năng ứng dụng trong thực tế, mở ra những cơ hội sáng tạo và phát triển mới cho xã hội.