Phản ứng đồng thể là một trong những khía cạnh quan trọng của hóa học mà mọi người thường ít chú ý đến. Một thế giới đầy bí ẩn nằm trong các phản ứng hóa học mà chúng ta thấy hàng ngày. Tại sao các chất lại tương tác với nhau? Tại sao có những phản ứng xảy ra một cách dễ dàng, trong khi những phản ứng khác lại cần có nhiệt độ hay áp suất đặc biệt? Tất cả câu hỏi đều được giải đáp qua việc tìm hiểu về phản ứng đồng thể, loại phản ứng mà mọi thành phần đều ở cùng một pha, tạo nên sự đồng nhất lý tưởng trong quá trình tương tác hóa học. Cùng khám phá chi tiết về phản ứng đồng thể này nhé!
Phản ứng đồng thể là gì?
Phản ứng đồng thể là phản ứng hóa học xảy ra hoàn toàn trong một pha duy nhất. Nói cách khác, tất cả các chất tham gia phản ứng đều tồn tại trong cùng một trạng thái vật lý (khí, lỏng hoặc dung dịch).
Minh họa về phản ứng đồng thể
Đặc điểm của phản ứng đồng thể
-
Một pha: Tất cả chất tham gia và sản phẩm đều ở cùng một pha.
-
Tương tác trực tiếp: Các phân tử của chất tham gia có thể tiếp xúc và tương tác trực tiếp với nhau trong suốt quá trình phản ứng.
-
Tốc độ phản ứng thường cao: Do các phân tử tiếp xúc trực tiếp nên khả năng va chạm và phản ứng giữa các phân tử cao hơn so với các phản ứng dị thể.
Cơ chế của phản ứng đồng thể
Cơ chế của phản ứng đồng thể thường đơn giản hơn so với phản ứng dị thể. Các phân tử chuyển động tự do trong môi trường, va chạm với nhau và khi có đủ năng lượng, các liên kết bị phá vỡ và hình thành liên kết mới để tạo ra sản phẩm.
Ví dụ về phản ứng đồng thể
Các loại phản ứng đồng thể
Phản ứng đồng thể, như đã đề cập, là loại phản ứng xảy ra hoàn toàn trong một pha. Dựa vào bản chất của chất tham gia và cơ chế phản ứng, ta có thể phân loại phản ứng đồng thể thành các loại sau:
Có nhiều loại phản ứng đồng thể khác nhau
1. Phản ứng trung hòa axit-bazơ
Đây là loại phản ứng đồng thể phổ biến nhất. Trong dung dịch, axit và bazơ phân ly thành ion, các ion này kết hợp với nhau tạo thành muối và nước.
Ví dụ: HCl (axit clohiđric) + NaOH (natri hidroxit) → NaCl (natri clorua) + H₂O (nước)
2. Phản ứng trao đổi ion
Là phản ứng giữa các chất điện ly trong dung dịch, trong đó các ion dương và ion âm đổi chỗ cho nhau.
Ví dụ: AgNO₃ (bạc nitrat) + NaCl (natri clorua) → AgCl (bạc clorua)↓ + NaNO₃ (natri nitrat)
3. Phản ứng oxi hóa khử
Trong phản ứng này, có sự chuyển dịch electron giữa các chất tham gia. Chất khử nhường electron, bị oxi hóa, còn chất oxi hóa nhận electron, bị khử.
Ví dụ: 2FeCl₂ (sắt (II) clorua) + Cl₂ (clo) → 2FeCl₃ (sắt (III) clorua)
4. Phản ứng phân hủy
Là phản ứng một chất phân hủy thành hai hoặc nhiều chất mới.
Ví dụ: 2H₂O₂ (hydrogen peroxide) → 2H₂O (nước) + O₂ (oxy)
5. Phản ứng tổng hợp
Là phản ứng hai hoặc nhiều chất kết hợp lại tạo thành một chất mới.
Ví dụ: N₂ (nitơ) + 3H₂ (hiđro) → 2NH₃ (amoniac)
6. Phản ứng este hóa
Là phản ứng giữa axit cacboxylic và ancol tạo thành este và nước.
Ví dụ: CH₃COOH (axit axetic) + C₂H₅OH (ethanol) ⇌ CH₃COOC₂H₅ (etyl axetat) + H₂O (nước)
7. Phản ứng trùng hợp
Là phản ứng kết hợp nhiều phân tử nhỏ (monome) giống nhau hoặc khác nhau tạo thành phân tử lớn (polime).
Ví dụ: nCH₂=CH₂ (etilen) → -(CH₂-CH₂)ₙ- (polyethylene)
Ứng dụng của phản ứng đồng thể trong công nghiệp
Phản ứng đồng thể, với đặc điểm xảy ra trong cùng một pha và tốc độ phản ứng thường cao, có rất nhiều ứng dụng quan trọng trong công nghiệp. Dưới đây là một số ví dụ điển hình:
1. Ngành hóa chất:
-
Sản xuất axit: Quá trình sản xuất axit sunfuric, axit nitric và nhiều loại axit khác thường liên quan đến các phản ứng đồng thể trong dung dịch.
-
Tổng hợp hữu cơ: Các phản ứng este hóa, trùng hợp, thế, cộng... để tạo ra các hợp chất hữu cơ như nhựa, cao su, dược phẩm đều là những phản ứng đồng thể.
-
Sản xuất phân bón: Quá trình tổng hợp amoniac (NH₃) từ nitơ và hydro là một ví dụ điển hình về phản ứng đồng thể có ý nghĩa lớn trong sản xuất phân bón.
2. Ngành năng lượng:

Ứng dụng trong quá lĩnh vực năng lượng
-
Đốt cháy nhiên liệu: Quá trình đốt cháy các nhiên liệu hóa thạch như khí đốt, dầu mỏ là những phản ứng đồng thể xảy ra trong pha khí.
-
Sản xuất pin: Các phản ứng oxi hóa khử trong pin là những phản ứng đồng thể cung cấp năng lượng điện.
3. Ngành thực phẩm:
-
Lên men: Quá trình lên men rượu, bia, sữa chua là những phản ứng đồng thể do các enzyme xúc tác.
-
Sản xuất thực phẩm: Nhiều quá trình chế biến thực phẩm như đường hóa tinh bột, thủy phân protein cũng liên quan đến các phản ứng đồng thể.
4. Ngành dược phẩm:
-
Tổng hợp thuốc: Hầu hết các quá trình tổng hợp dược phẩm đều liên quan đến các phản ứng đồng thể trong dung dịch.
-
Phân tích dược phẩm: Các phản ứng đồng thể được sử dụng để định lượng và xác định chất lượng của dược phẩm.
5. Ngành xử lý nước:
6. Ngành sơn:
So sánh phản ứng đồng thể với phản ứng dị thể
Phản ứng đồng thể và phản ứng dị thể là hai loại phản ứng hóa học cơ bản, được phân loại dựa trên số pha tồn tại trong hệ phản ứng. Mỗi loại phản ứng có những đặc điểm riêng biệt, ảnh hưởng đến tốc độ và cơ chế phản ứng. Bảng so sánh chi tiết dưới đây:
|
Đặc điểm
|
Phản ứng đồng thể
|
Phản ứng dị thể
|
|
Số pha
|
Một pha
|
Hai pha hoặc nhiều pha
|
|
Môi trường phản ứng
|
Toàn bộ thể tích của một pha
|
Bề mặt tiếp xúc giữa các pha
|
|
Ví dụ
|
Trung hòa axit-bazơ trong dung dịch, đốt cháy khí metan
|
Gỉ sét, hòa tan đá vôi trong axit, tổng hợp amoniac
|
|
Tốc độ phản ứng
|
Thường cao
|
Thường thấp hơn
|
|
Yếu tố ảnh hưởng
|
Nồng độ, nhiệt độ, áp suất, chất xúc tác
|
Diện tích bề mặt, nhiệt độ, nồng độ, áp suất, chất xúc tác
|
|
Cơ chế phản ứng
|
Va chạm và tương tác giữa các phân tử
|
Hấp phụ, phản ứng trên bề mặt, khử hấp phụ
|
|
Ứng dụng
|
Hầu hết các phản ứng hóa học trong dung dịch
|
Công nghiệp hóa chất, luyện kim, xử lý môi trường, pin
|
Giải thích chi tiết
-
Phản ứng đồng thể:
-
Một pha: Tất cả các chất tham gia và sản phẩm đều ở cùng một trạng thái vật lý (khí, lỏng hoặc dung dịch).
-
Tương tác trực tiếp: Các phân tử có thể tự do chuyển động và va chạm trực tiếp với nhau, tạo điều kiện thuận lợi cho phản ứng xảy ra.
-
Tốc độ cao: Do khả năng tiếp xúc và va chạm cao nên tốc độ phản ứng thường nhanh.
-
Ví dụ: Phản ứng trung hòa axit-bazơ trong dung dịch, phản ứng đốt cháy khí metan.
-
Phản ứng dị thể:
-
Nhiều pha: Các chất tham gia ở các pha khác nhau (ví dụ: chất rắn và chất lỏng, khí và chất rắn).
-
Tương tác qua bề mặt: Phản ứng chủ yếu xảy ra trên bề mặt tiếp xúc giữa các pha.
-
Tốc độ thường thấp hơn: Do diện tích bề mặt tiếp xúc hạn chế nên tốc độ phản ứng thường chậm hơn.
-
Ví dụ: Gỉ sét (sắt phản ứng với oxy trong không khí), hòa tan đá vôi trong axit (chất rắn và chất lỏng).
Tác động của điều kiện môi trường đến phản ứng đồng thể
Phản ứng đồng thể, diễn ra hoàn toàn trong một pha, rất nhạy cảm với sự thay đổi của điều kiện môi trường. Các yếu tố như nhiệt độ, nồng độ, áp suất, chất xúc tác và dung môi đều có thể ảnh hưởng đáng kể đến tốc độ và hiệu suất của phản ứng.
1. Nhiệt độ
-
Ảnh hưởng: Tăng nhiệt độ làm tăng tốc độ chuyển động của các phân tử, tăng tần suất va chạm hiệu quả, từ đó làm tăng tốc độ phản ứng.
-
Giải thích: Theo quy tắc Van't Hoff, khi nhiệt độ tăng 10°C, tốc độ phản ứng thường tăng gấp 2-4 lần.
-
Ví dụ: Phản ứng nấu ăn diễn ra nhanh hơn ở nhiệt độ cao.
2. Nồng độ
-
Ảnh hưởng: Tăng nồng độ chất tham gia làm tăng số lượng phân tử trong một đơn vị thể tích, tăng tần suất va chạm hiệu quả, từ đó làm tăng tốc độ phản ứng.
-
Ví dụ: Đốt một mẩu giấy nhỏ cháy nhanh hơn khi quạt mạnh (tăng nồng độ oxy).
3. Áp suất
-
Ảnh hưởng: Áp suất chủ yếu ảnh hưởng đến các phản ứng có chất khí tham gia. Tăng áp suất làm tăng nồng độ các chất khí, từ đó tăng tốc độ phản ứng.
-
Ví dụ: Tổng hợp amoniac từ nitơ và hydro được thực hiện ở áp suất cao để tăng hiệu suất.
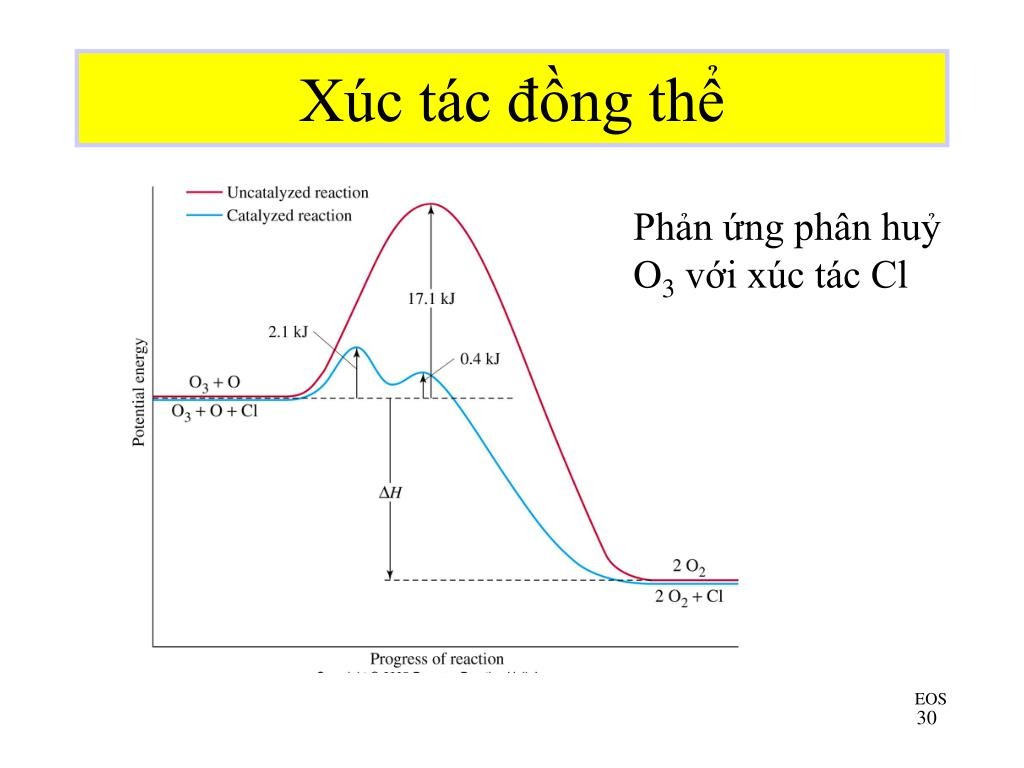
4. Chất xúc tác
-
Ảnh hưởng: Chất xúc tác làm giảm năng lượng hoạt hóa của phản ứng, giúp phản ứng xảy ra nhanh hơn mà không bị tiêu hao trong quá trình phản ứng.
-
Ví dụ: Enzyme trong cơ thể là những chất xúc tác sinh học giúp các phản ứng sinh hóa diễn ra nhanh chóng.
5. Dung môi
-
Ảnh hưởng: Dung môi ảnh hưởng đến độ phân cực, hằng số điện môi, khả năng hòa tan của các chất tham gia, từ đó ảnh hưởng đến tốc độ và cân bằng của phản ứng.
-
Ví dụ: Phản ứng este hóa thường được thực hiện trong môi trường axit để tăng tốc độ phản ứng.
Các yếu tố khác
-
Diện tích bề mặt: Đối với phản ứng dị thể (xảy ra ở bề mặt tiếp xúc giữa các pha), tăng diện tích bề mặt tiếp xúc làm tăng tốc độ phản ứng.
-
Ánh sáng: Một số phản ứng quang hóa cần ánh sáng để kích hoạt.
Kết luận, phản ứng đồng thể không chỉ đơn thuần là một quá trình hóa học mà còn là một lĩnh vực đầy hứa hẹn với nhiều ứng dụng thiết thực trong đời sống và công nghiệp. Việc tích hợp nghiên cứu sâu vào phản ứng này sẽ tiếp tục giúp chúng ta khám phá ra nhiều điều mới mẻ và cải tiến trong công nghệ hóa học, từ sản xuất thực phẩm cho đến dược phẩm. Dongachem.vn hy vọng rằng bài viết này đã mang lại cho bạn cái nhìn sâu sắc hơn về thế giới thú vị của phản ứng đồng thể!