Liên kết kim loại là một hiện tượng hấp dẫn trong thế giới hóa học, nơi các nguyên tử kim loại hòa quyện thành một khối thống nhất nhờ vào biển electron tự do. Vậy tại sao liên kết này lại có sức hút mạnh mẽ đến vậy? Trong bài viết này, hãy cùng dongachem.vn khám phá sâu sắc về liên kết kim loại là gì, từ khái niệm cơ bản đến những ứng dụng và các ví dụ điển hình trong cuộc sống.
Khái niệm liên kết kim loại là gì?
Liên kết kim loại là một loại liên kết hóa học đặc trưng cho các kim loại, trong đó các electron hóa trị của các nguyên tử kim loại được tự do di chuyển trong toàn bộ mạng tinh thể. Điều này tạo ra một "biển electron" bao quanh các ion dương của kim loại, tạo nên một liên kết mạnh mẽ giữa chúng.
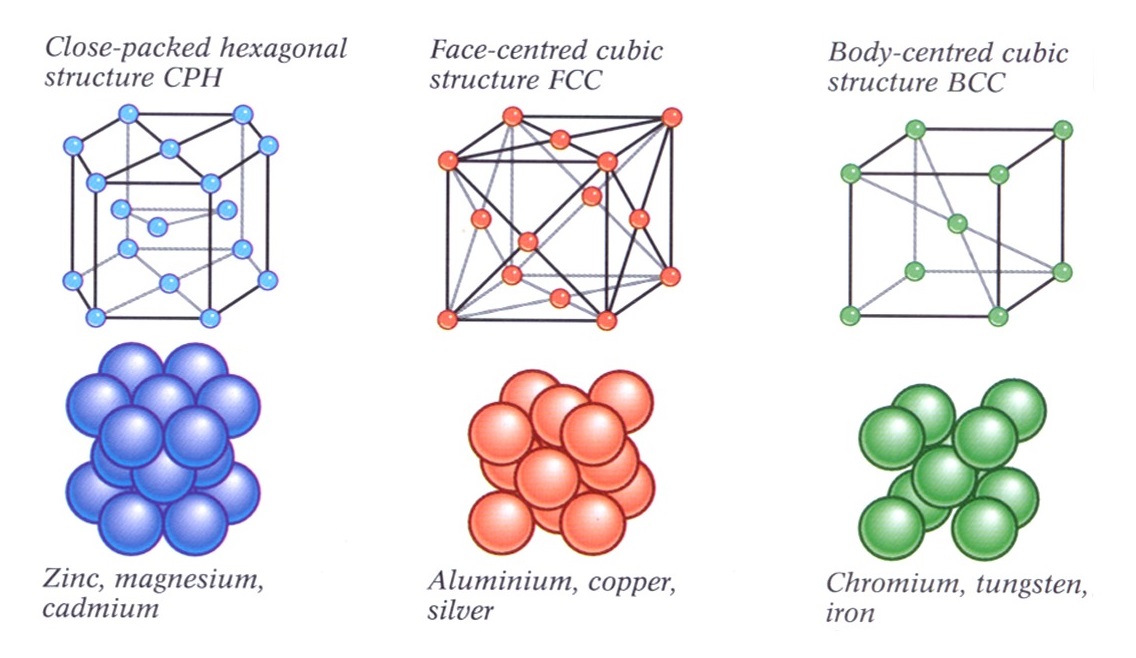
Một số cấu trúc liên kết trong các kim loại điển hình
Đặc điểm của liên kết kim loại:
-
Biển electron: Các electron hóa trị không thuộc về nguyên tử nào cả mà di chuyển tự do trong toàn bộ mạng tinh thể.
-
Tính dẫn điện: Do sự di chuyển tự do của các electron, kim loại dẫn điện tốt.
-
Tính dẫn nhiệt: Các electron tự do cũng tham gia vào quá trình truyền nhiệt, khiến kim loại dẫn nhiệt tốt.
-
Tính dẻo: Các lớp nguyên tử trong kim loại có thể trượt lên nhau mà không làm đứt các liên kết, tạo nên tính dẻo cho kim loại.
-
Ánh kim: Các electron tự do hấp thụ và phát ra ánh sáng ở nhiều bước sóng khác nhau, tạo nên ánh kim đặc trưng cho kim loại.
Mô hình về liên kết kim loại:
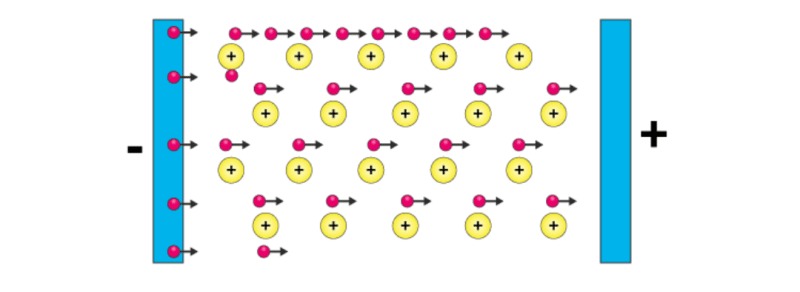
Hình ảnh trên minh họa mô hình biển electron trong liên kết kim loại. Các chấm màu xanh biểu diễn các electron tự do di chuyển trong mạng tinh thể kim loại, trong khi các hình cầu màu đỏ biểu diễn các ion dương của kim loại.
Cấu trúc tinh thể trong liên kết kim loại:
Các nguyên tử kim loại sắp xếp một cách đều đặn trong không gian, tạo thành một mạng tinh thể. Cấu trúc tinh thể này có thể là đơn giản (như mạng lập phương tâm khối) hoặc phức tạp hơn (như mạng lục giác).
Đặc điểm của cấu trúc tinh thể kim loại:
-
Gọn gàng: Các nguyên tử sắp xếp chặt chẽ để tạo thành một cấu trúc ổn định.
-
Đều đặn: Các nguyên tử lặp lại theo một trật tự nhất định trong không gian.
-
Ít khuyết tật: Các khuyết tật trong mạng tinh thể có thể ảnh hưởng đến tính chất của kim loại.
Ứng dụng của liên kết kim loại
Liên kết kim loại, với đặc tính độc đáo về biển electron và cấu trúc tinh thể, đã mang đến cho kim loại những tính chất vật lý đặc trưng như độ dẫn điện, độ dẫn nhiệt, tính dẻo, ánh kim. Chính những tính chất này đã mở ra vô vàn ứng dụng của kim loại trong đời sống và công nghiệp.
Liên kết kim loại có nhiều ứng dụng trong đời sống
1. Ngành xây dựng:
-
Vật liệu xây dựng: Sắt thép, nhôm được sử dụng rộng rãi để xây dựng nhà cửa, cầu cống, tòa nhà cao tầng. Tính bền, chắc chắn và khả năng chịu lực tốt của kim loại giúp các công trình trở nên vững chắc và an toàn.
-
Ống dẫn nước: Ống đồng, ống thép được sử dụng để vận chuyển nước, khí gas... nhờ khả năng chịu áp lực và chống ăn mòn tốt.
2. Ngành công nghiệp:
-
Máy móc, thiết bị: Kim loại được sử dụng để chế tạo các bộ phận máy móc, thiết bị như trục, bánh răng, vỏ máy... Nhờ tính cứng, độ bền và khả năng gia công tốt.
-
Ô tô, xe máy: Thép, nhôm là những vật liệu chính để sản xuất khung xe, vỏ xe, động cơ... Nhờ trọng lượng nhẹ, độ bền cao và khả năng hấp thụ xung lực tốt.
-
Điện tử: Đồng, nhôm được sử dụng làm dây dẫn điện, các linh kiện điện tử nhờ tính dẫn điện tốt.
3. Đời sống:
-
Đồ dùng gia đình: Nhiều đồ dùng trong gia đình được làm từ kim loại như nồi, chảo, dao kéo... Nhờ tính dẫn nhiệt tốt, bền và dễ vệ sinh.
-
Đồ trang sức: Vàng, bạc, bạch kim được sử dụng để làm đồ trang sức nhờ vẻ đẹp, độ bền và tính quý hiếm.
4. Các ứng dụng khác:
-
Ngành hàng không vũ trụ: Các hợp kim nhôm, titan được sử dụng để chế tạo máy bay, tàu vũ trụ nhờ tính nhẹ, bền và chịu nhiệt tốt.
-
Y tế: Các dụng cụ phẫu thuật, máy móc y tế được làm từ thép không gỉ nhờ tính trơ với các chất hóa học và dễ vệ sinh.
-
Năng lượng: Kim loại được sử dụng trong các pin, acquy, tuabin gió...
So sánh liên kết kim loại với các loại liên kết khác
Liên kết kim loại là một trong những loại liên kết hóa học cơ bản, cùng với liên kết ion và liên kết cộng hóa trị. Mỗi loại liên kết có những đặc điểm riêng biệt, ảnh hưởng đến tính chất của chất.
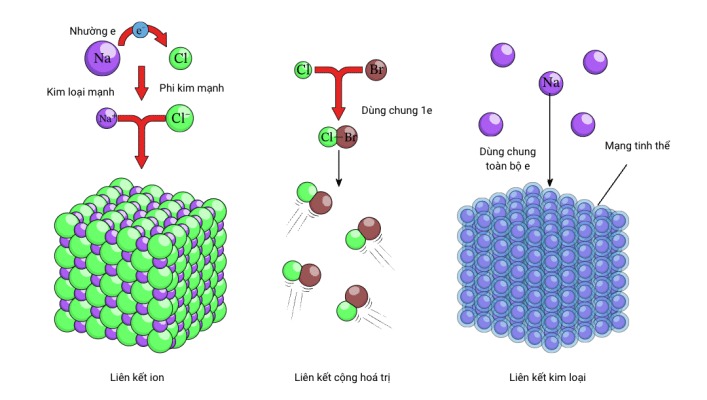
Hình ảnh minh họa so sánh liên kết kim loại với các liên kết khác
1. Liên kết kim loại so với liên kết ion
2. Liên kết kim loại so với liên kết cộng hóa trị
Dưới đây là bảng so sánh tóm tắt:
|
Đặc điểm
|
Liên kết ion
|
Liên kết cộng hóa trị
|
Liên kết kim loại
|
|
Loại hạt tham gia
|
Ion dương và ion âm
|
Nguyên tử phi kim
|
Nguyên tử kim loại
|
|
Cách hình thành
|
Chuyển electron
|
Dùng chung electron
|
Biển electron
|
|
Tính chất chất
|
Chất rắn, giòn, nhiệt độ nóng chảy cao, dẫn điện khi nóng chảy hoặc tan trong nước
|
Chất rắn, lỏng hoặc khí, không dẫn điện khi ở trạng thái rắn, thường tan trong dung môi không phân cực
|
Chất rắn, dẻo, dẫn điện và dẫn nhiệt tốt, có ánh kim
|
Các ví dụ minh họa về liên kết kim loại
Liên kết kim loại là một loại liên kết hóa học đặc trưng cho các kim loại, tạo nên nhiều tính chất vật lý và hóa học đặc biệt. Để hiểu rõ hơn về loại liên kết này, chúng ta hãy cùng xem xét một số ví dụ cụ thể:
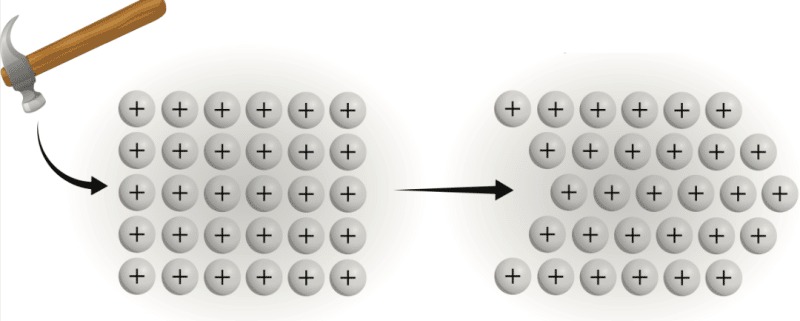
Cơ chế của liên kết kim loại điển hình
1. Đồng (Cu):
-
Cấu trúc: Các nguyên tử đồng sắp xếp theo mạng tinh thể lập phương tâm diện, tạo thành một cấu trúc rất chặt chẽ.
-
Tính chất: Đồng có tính dẫn điện và dẫn nhiệt rất tốt, có màu đỏ đặc trưng và có độ dẻo cao.
-
Ứng dụng: Được sử dụng rộng rãi trong các dây dẫn điện, ống dẫn nước, sản xuất đồ dùng gia đình.
2. Nhôm (Al):
-
Cấu trúc: Nhôm có cấu trúc tinh thể lập phương tâm diện.
-
Tính chất: Nhôm nhẹ, bền, có tính dẫn điện và dẫn nhiệt tốt, dễ gia công.
-
Ứng dụng: Được sử dụng trong sản xuất đồ dùng gia đình, vỏ máy bay, ô tô, cửa sổ...
3. Sắt (Fe):
-
Cấu trúc: Sắt có thể tồn tại ở nhiều dạng thù hình khác nhau, mỗi dạng có cấu trúc tinh thể riêng.
-
Tính chất: Sắt có tính dẻo, dễ rèn, có từ tính.
-
Ứng dụng: Được sử dụng để sản xuất thép, gang, các vật liệu xây dựng, máy móc, thiết bị.
4. Vàng (Au):
-
Cấu trúc: Vàng có cấu trúc tinh thể lập phương tâm diện.
-
Tính chất: Vàng có màu vàng đặc trưng, rất mềm, dẻo, không bị oxi hóa trong không khí.
-
Ứng dụng: Được sử dụng làm đồ trang sức, tiền tệ, vật liệu điện tử.
5. Bạc (Ag):
-
Cấu trúc: Bạc có cấu trúc tinh thể lập phương tâm diện.
-
Tính chất: Bạc có màu trắng bạc, dẫn điện tốt nhất trong tất cả các kim loại.
-
Ứng dụng: Được sử dụng làm đồ trang sức, vật liệu điện tử, sản xuất gương.
Các ví dụ khác:
-
Kẽm (Zn): Được sử dụng để mạ kẽm cho các vật dụng bằng sắt để chống gỉ sét.
-
Thiếc (Sn): Được sử dụng để hàn các mối nối điện tử.
-
Chì (Pb): Được sử dụng để sản xuất ắc quy.
Liên kết kim loại trong các hợp kim
Hợp kim là vật liệu được tạo thành từ sự kết hợp của hai hoặc nhiều nguyên tố hóa học, trong đó ít nhất một nguyên tố là kim loại. Liên kết kim loại đóng vai trò quan trọng trong việc tạo thành và duy trì cấu trúc của các hợp kim.
Cơ chế hình thành liên kết kim loại trong hợp kim
Trong hợp kim, các nguyên tử kim loại khác nhau cùng góp electron vào "biển electron" chung. Các ion kim loại mang điện tích dương sẽ bị các electron tự do này hút lại, tạo thành liên kết kim loại.
Ảnh hưởng của liên kết kim loại đến tính chất hợp kim
Liên kết kim loại trong hợp kim mang đến những đặc tính độc đáo, làm cho hợp kim có những ưu điểm vượt trội so với các kim loại nguyên chất.
-
Độ bền: Liên kết kim loại tạo ra một mạng lưới liên kết chặt chẽ, giúp hợp kim có độ bền cao hơn so với các kim loại thành phần.
-
Độ cứng: Bằng cách thay đổi thành phần các nguyên tố trong hợp kim, người ta có thể điều chỉnh độ cứng của hợp kim theo yêu cầu.
-
Khả năng chống ăn mòn: Một số hợp kim có khả năng chống ăn mòn tốt hơn so với các kim loại nguyên chất, nhờ vào sự hình thành một lớp màng oxit bảo vệ trên bề mặt.
-
Điểm nóng chảy: Điểm nóng chảy của hợp kim thường khác với điểm nóng chảy của các kim loại thành phần.
-
Tính dẻo: Tính dẻo của hợp kim có thể thay đổi tùy thuộc vào thành phần và cấu trúc của hợp kim.
Các ví dụ về hợp kim và ứng dụng
-
Thép: Là hợp kim của sắt và carbon, cùng với một số nguyên tố khác như mangan, silic. Thép có độ bền cao, cứng và được sử dụng rộng rãi trong xây dựng, sản xuất ô tô, máy móc.
-
Đồng thau: Là hợp kim của đồng và kẽm. Đồng thau có màu vàng, cứng hơn đồng và dễ gia công, được sử dụng để làm các sản phẩm trang trí, phụ kiện.
-
Nhôm hợp kim: Là hợp kim của nhôm với các nguyên tố khác như magiê, silic. Nhôm hợp kim nhẹ, bền, chống ăn mòn tốt, được sử dụng rộng rãi trong ngành hàng không vũ trụ, xây dựng.
-
Hợp kim siêu bền: Là các hợp kim có độ bền rất cao, thường được sử dụng trong các ứng dụng đặc biệt như chế tạo động cơ máy bay, tàu vũ trụ.
Các yếu tố ảnh hưởng đến liên kết kim loại
Liên kết kim loại, với đặc trưng là "biển electron" bao quanh các ion dương, là yếu tố quyết định nhiều tính chất vật lý của kim loại như độ cứng, độ dẻo, tính dẫn điện, dẫn nhiệt. Tuy nhiên, liên kết này không phải là tĩnh tại mà chịu ảnh hưởng bởi nhiều yếu tố khác nhau.
1. Số lượng electron hóa trị:
-
Ảnh hưởng: Số lượng electron hóa trị càng lớn, "biển electron" càng dày đặc, liên kết kim loại càng mạnh. Điều này dẫn đến kim loại có điểm nóng chảy và nhiệt độ sôi cao hơn.
-
Ví dụ: Các kim loại nhóm IB (đồng, bạc, vàng) có một electron hóa trị nên liên kết kim loại yếu hơn so với các kim loại nhóm IIA (magie, canxi) có hai electron hóa trị.
2. Kích thước nguyên tử:
-
Ảnh hưởng: Khi kích thước nguyên tử tăng, khoảng cách giữa các hạt nhân nguyên tử cũng tăng, làm giảm lực hút giữa các ion dương và electron tự do. Điều này làm yếu liên kết kim loại.
-
Ví dụ: Các kim loại kiềm (natri, kali) có kích thước nguyên tử lớn nên liên kết kim loại yếu hơn so với các kim loại chuyển tiếp (sắt, đồng).
3. Cấu trúc tinh thể:
-
Ảnh hưởng: Cấu trúc tinh thể quyết định sự sắp xếp của các nguyên tử trong không gian. Các cấu trúc tinh thể khác nhau sẽ dẫn đến độ chặt khít của mạng tinh thể khác nhau, từ đó ảnh hưởng đến cường độ của liên kết kim loại.
-
Ví dụ: Kim loại có cấu trúc lập phương tâm diện (FCC) thường có tính dẻo cao hơn so với kim loại có cấu trúc lập phương tâm khối (BCC).
4. Nhiệt độ:
-
Ảnh hưởng: Khi nhiệt độ tăng, các nguyên tử dao động mạnh hơn, làm giảm cường độ liên kết kim loại. Điều này giải thích tại sao khi đun nóng kim loại, độ bền của nó giảm đi.
5. Áp suất:
6. Tạp chất:
-
Ảnh hưởng: Sự có mặt của tạp chất trong kim loại có thể làm thay đổi cấu trúc tinh thể, tạo ra các khuyết tật, làm yếu liên kết kim loại.
-
Ví dụ: Các hợp kim thường có độ bền cao hơn so với kim loại nguyên chất là do sự có mặt của các nguyên tố tạp chất làm tăng cường độ liên kết tại các vị trí khuyết tật.
7. Các lực khác:
-
Lực Van der Waals: Giữa các nguyên tử kim loại cũng tồn tại lực Van der Waals, tuy nhiên lực này yếu hơn so với lực hút giữa ion dương và electron tự do.
-
Lực liên kết cộng hóa trị: Trong một số hợp kim, có thể tồn tại liên kết cộng hóa trị giữa các nguyên tử, ảnh hưởng đến tính chất của hợp kim.
Liên kết kim loại không chỉ đơn thuần là một phần nhỏ trong lĩnh vực hóa học mà thực sự là một nguyên lý cơ bản ảnh hưởng đến cả thế giới vật chất xung quanh chúng ta. Với việc phân tích sâu sắc về khái niệm liên kết kim loại là gì, đặc điểm, ứng dụng và so sánh với các loại liên kết khác, chúng ta đã một phần nào đó nhận ra vai trò quan trọng của liên kết kim loại trong tự nhiên và trong nhiều lĩnh vực công nghiệp. Những hiểu biết này không chỉ giúp mở rộng kiến thức mà còn có thể ứng dụng vào thực tiễn trong cuộc sống hàng ngày. Dongachem.vn hy vọng rằng qua bài viết này, chúng ta sẽ có cái nhìn mới mẻ hơn về những vật liệu kim loại mà chúng ta thường sử dụng, từ đó biết cách bảo quản, ứng dụng chúng một cách hiệu quả nhất.