Khi nghiên cứu về hóa học, có một khối kiến thức thú vị và kỳ diệu đang chờ đón chúng ta khám phá – đó chính là liên kết ion. Hầu như mọi thứ xung quanh ta đều có sự tồn tại của các loại liên kết khác nhau, nhưng liên kết ion lại đặc biệt nổi bật với tính chất giúp hình thành nên những cấu trúc tinh thể đẹp đẽ. Hãy cùng dongachem.vn khám phá liên kết ion là gì qua bài viết dưới đây!
Khái niệm liên kết ion là gì?
Liên kết ion là một loại liên kết hóa học hình thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu. Nói một cách đơn giản, đây là sự kết hợp giữa các nguyên tử kim loại (dễ mất electron) và phi kim (dễ nhận electron).
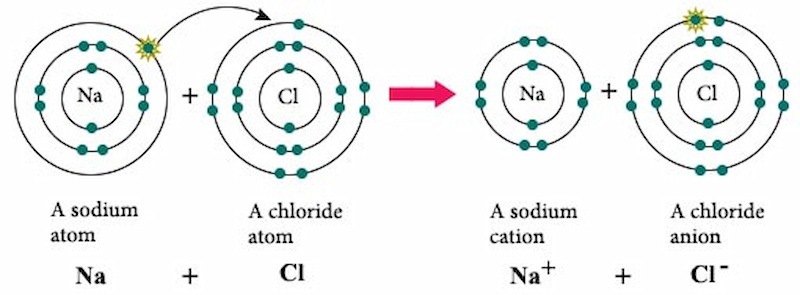
Liên kết ion được hình thành do lực hút tĩnh điện
Quá trình hình thành liên kết ion
-
Ion hóa:
-
Nguyên tử kim loại: Dễ dàng mất electron lớp ngoài cùng để đạt cấu hình electron bền vững của khí hiếm, trở thành ion dương (cation).
-
Nguyên tử phi kim: Dễ dàng nhận electron để đạt cấu hình electron bền vững của khí hiếm, trở thành ion âm (anion).
-
Tạo thành liên kết:
Đặc điểm của hợp chất ion
-
Tinh thể ion: Các hợp chất ion thường tạo thành tinh thể ion có cấu trúc mạng tinh thể đều đặn.
-
Điểm nóng chảy và sôi cao: Do lực hút tĩnh điện mạnh giữa các ion nên cần rất nhiều năng lượng để phá vỡ mạng tinh thể.
-
Khả năng dẫn điện: Hợp chất ion rắn không dẫn điện do các ion bị cố định trong mạng tinh thể. Tuy nhiên, khi nóng chảy hoặc hòa tan trong nước, chúng sẽ dẫn điện do các ion tự do chuyển động.
-
Giòn: Tinh thể ion rất giòn vì khi bị tác động, các lớp ion bị trượt so với nhau, các ion cùng dấu xô đẩy nhau dẫn đến tinh thể bị vỡ.
Các yếu tố ảnh hưởng đến hình thành liên kết ion
-
Độ âm điện: Sự chênh lệch độ âm điện giữa hai nguyên tử càng lớn thì khả năng hình thành liên kết ion càng cao.
-
Năng lượng ion hóa: Năng lượng ion hóa của kim loại càng nhỏ và độ affinity electron của phi kim càng lớn thì quá trình hình thành ion càng dễ xảy ra.
-
Cấu hình electron: Các nguyên tử có xu hướng đạt cấu hình electron bền vững của khí hiếm nên dễ dàng tham gia vào quá trình hình thành liên kết ion.
Ứng dụng của liên kết ion là gì?
Liên kết ion, với tính chất đặc trưng của nó, đã và đang đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống. Dưới đây là một số ứng dụng điển hình:
Liên kết ion được ứng dụng trong nhiều lĩnh vực khác nhau
1. Công nghiệp:
-
Sản xuất vật liệu xây dựng: Các hợp chất ion như xi măng, vôi sống được sử dụng rộng rãi trong xây dựng. Khi trộn với nước, chúng tạo thành các tinh thể ion liên kết chặt chẽ, tạo nên cấu trúc vững chắc cho các công trình.
-
Sản xuất gốm sứ: Gốm sứ được tạo ra từ hỗn hợp các hợp chất ion, khi nung ở nhiệt độ cao, các ion liên kết chặt chẽ tạo nên sản phẩm cứng, bền và chịu nhiệt tốt.
-
Sản xuất thủy tinh: Thủy tinh cũng là một loại vật liệu vô cơ không tinh thể, được tạo thành từ hỗn hợp các oxit kim loại (là hợp chất ion).
2. Điện tử:
-
Pin: Nhiều loại pin sử dụng các hợp chất ion làm chất điện ly để tạo ra dòng điện. Ví dụ: pin lithium-ion.
-
Tấm pin mặt trời: Một số loại tấm pin mặt trời sử dụng các chất bán dẫn có liên kết ion để chuyển đổi năng lượng ánh sáng thành điện năng.
3. Y tế:
-
Thuốc: Nhiều loại thuốc là các hợp chất ion, chúng tác động đến các quá trình sinh hóa trong cơ thể bằng cách tương tác với các ion khác.
-
Chẩn đoán hình ảnh: Các chất tương phản dùng trong chụp X-quang, MRI thường là các hợp chất ion có khả năng hấp thụ bức xạ.
4. Nông nghiệp:
5. Sinh học:
-
Enzyme: Nhiều enzyme có vai trò xúc tác các phản ứng sinh hóa trong cơ thể là các protein chứa các nhóm chức có bản chất ion.
-
Axit nucleic: ADN và ARN là các đại phân tử sinh học có cấu trúc dựa trên liên kết ion giữa các base nitơ.
6. Môi trường:
Các yếu tố ảnh hưởng đến độ bền của liên kết ion
Độ bền của liên kết ion là một yếu tố quan trọng quyết định tính chất vật lý và hóa học của hợp chất ion. Nó phụ thuộc vào nhiều yếu tố khác nhau, bao gồm:
Có nhiều yếu tố ảnh hưởng tới liên kết ion
1. Độ âm điện của các nguyên tố:
-
Định nghĩa: Độ âm điện là khả năng hút electron về phía mình của một nguyên tử khi tạo thành liên kết hóa học.
-
Ảnh hưởng: Sự chênh lệch độ âm điện giữa hai nguyên tử càng lớn thì lực hút tĩnh điện giữa cation và anion càng mạnh, dẫn đến liên kết ion càng bền vững.
2. Cỡ ion:
3. Điện tích của ion:
4. Cấu trúc tinh thể:
5. Nhiệt độ:
-
Ảnh hưởng: Khi nhiệt độ tăng, các ion dao động mạnh hơn, làm giảm lực hút tĩnh điện giữa chúng. Do đó, độ bền của liên kết ion giảm.
6. Môi trường:
Cách viết công thức hóa học của hợp chất ion
Công thức hóa học của hợp chất ion thể hiện tỉ lệ số nguyên tử (hoặc ion đa nguyên tử) của các nguyên tố tạo nên hợp chất đó. Để viết đúng công thức hóa học của hợp chất ion, ta cần tuân thủ quy tắc tổng điện tích bằng 0. Các bước viết công thức hóa học hợp chất ion:
-
Xác định các ion tạo thành hợp chất:
-
Ion đơn nguyên tử: Là ion được tạo thành từ một nguyên tử. Ví dụ: Na+, Cl-, Ca2+, O2-.
-
Ion đa nguyên tử: Là ion được tạo thành từ nhiều nguyên tử. Ví dụ: SO42-, NO3-, NH4+.
-
Viết công thức của các ion: Viết ký hiệu của nguyên tố và ghi điện tích của ion ở góc trên bên phải.
-
Cân bằng điện tích:
Lưu ý:
-
Thứ tự viết: Thường viết cation trước, anion sau.
-
Ngoại lệ: Một số hợp chất ion có thể có cấu trúc phức tạp hơn, cần áp dụng các quy tắc bổ sung.
Nhìn chung, liên kết ion là một phần không thể thiếu trong hóa học, với những ứng dụng phong phú trong cuộc sống hằng ngày. Từ muối ăn cho đến các sản phẩm công nghiệp, sự kết hợp giữa các nguyên tố tạo nên những hợp chất ion đem lại cho chúng ta những giá trị thiết thực. Dongachem.vn hy vọng rằng qua bài viết này, bạn đã có cái nhìn sâu sắc hơn về liên kết ion là gì, từ nguyên lý hình thành cho đến các yếu tố quyết định sự bền vững của chúng trong thế giới hóa học phong phú và đa dạng.