Liên kết hóa học là một khái niệm quan trọng trong hóa học, chi phối mọi sự tương tác giữa các nguyên tử. Nhưng bạn có bao giờ tự hỏi rằng, tại sao các nguyên tử lại muốn "gắn bó" với nhau? Chính những liên kết này tạo nên sự đa dạng phong phú của vật chất mà chúng ta thấy xung quanh mình. Hãy cùng dongachem.vn khám phá xem liên kết hóa học là gì, đặc điểm và ứng dụng của chúng trong thực tiễn.
Giải đáp liên kết hóa học là gì?
Liên kết hóa học là lực hút giữa các nguyên tử, tạo nên các phân tử hay tinh thể bền vững. Nói cách khác, đây là "keo dán" giữ cho các nguyên tử kết hợp với nhau để tạo thành mọi vật chất xung quanh chúng ta, từ một hạt cát nhỏ bé đến cơ thể con người.
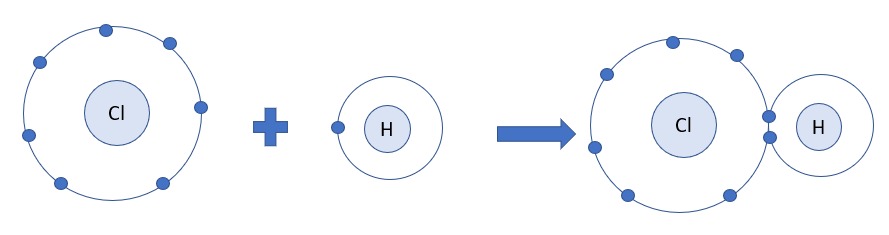
Giải đáp liên kết hóa học là gì?
Tại sao các nguyên tử lại liên kết với nhau?
Tất cả các nguyên tử đều có xu hướng đạt được trạng thái ổn định nhất, thường là khi lớp electron ngoài cùng của chúng bão hòa. Để đạt được trạng thái ổn định này, các nguyên tử có thể:
-
Nhường electron: Các nguyên tử kim loại thường dễ dàng nhường electron để đạt cấu hình electron của khí hiếm đứng trước.
-
Nhận electron: Các nguyên tử phi kim thường dễ dàng nhận electron để đạt cấu hình electron của khí hiếm đứng sau.
-
Góp chung electron: Các nguyên tử có thể góp chung electron để cùng đạt cấu hình electron bền vững.
Đặc điểm của Liên Kết Hóa Học
Liên kết hóa học mang đến cho các chất những tính chất đặc trưng. Dựa vào bản chất của liên kết, ta có thể chia liên kết hóa học thành các loại chính sau:
-
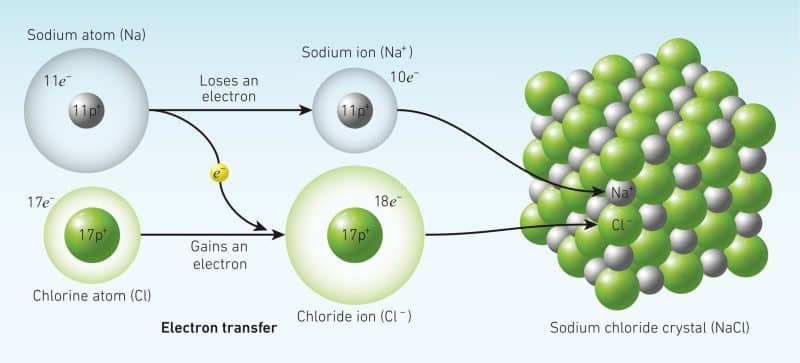
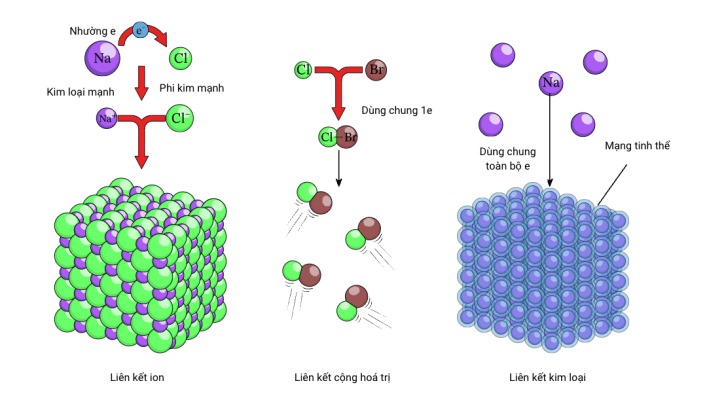
Liên kết ion: Hình thành giữa kim loại và phi kim. Liên kết ion là lực hút tĩnh điện giữa ion dương (cation) và ion âm (anion).
-
Liên kết cộng hóa trị: Hình thành khi hai nguyên tử góp chung electron để tạo thành cặp electron chung.
-
Liên kết kim loại: Liên kết đặc trưng cho kim loại, trong đó các electron tự do chuyển động tự do giữa các ion dương.
-
Liên kết hydrogen: Là liên kết yếu giữa nguyên tử H của một phân tử và nguyên tử F, O hoặc N của phân tử khác.
Ý Nghĩa của Liên kết Hóa Học
Liên kết hóa học đóng vai trò cực kỳ quan trọng trong việc hình thành các chất, từ đơn chất đến hợp chất, từ phân tử nhỏ đến các đại phân tử sinh học.
-
Xác định tính chất của chất: Loại liên kết hóa học quyết định nhiều tính chất vật lý và hóa học của chất như độ cứng, nhiệt độ nóng chảy, nhiệt độ sôi, tính dẫn điện, dẫn nhiệt,...
-
Giải thích hiện tượng tự nhiên: Liên kết hóa học giúp giải thích các hiện tượng tự nhiên như sự hình thành muối, sự cháy, sự hòa tan,...
-
Ứng dụng trong công nghiệp và đời sống: Hiểu về liên kết hóa học giúp con người tạo ra các vật liệu mới, chế tạo thuốc, phân bón,...
Ví dụ:
-
Liên kết ion trong muối ăn (NaCl) khiến muối ăn tan trong nước và dẫn điện khi nóng chảy.
-
Liên kết cộng hóa trị trong phân tử nước (H2O) tạo cho nước tính phân cực và khả năng hòa tan nhiều chất.
-
Liên kết kim loại trong đồng giúp đồng dẫn điện tốt, được sử dụng làm dây dẫn điện.
Các loại liên kết hóa học chính
Liên kết hóa học là lực hút giữa các nguyên tử, ion hoặc phân tử, tạo thành các hợp chất hóa học. Dựa vào bản chất của lực hút, ta có thể phân loại liên kết hóa học thành các loại chính sau:
Có nhiều loại liên kết hóa học khác nhau
1. Liên kết Ion
2. Liên kết Cộng Hóa Trị
-
Hình thành: Khi hai nguyên tử góp chung electron để tạo thành cặp electron chung.
-
Đặc điểm:
-
Có thể là liên kết đơn, đôi hoặc ba.
-
Có thể phân cực hoặc không phân cực.
-
Hợp chất cộng hóa trị thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn hợp chất ion.
-
Liên kết cộng hóa trị phân cực: Cặp electron chung bị lệch về phía nguyên tử có độ âm điện lớn hơn.
-
Liên kết cộng hóa trị không phân cực: Cặp electron chung nằm giữa hai nguyên tử.
3. Liên Kết Kim Loại
4. Liên Kết Hiđro
-
Hình thành: Là liên kết yếu giữa nguyên tử H của một phân tử và nguyên tử F, O hoặc N của phân tử khác.
-
Đặc điểm:
-
Liên kết yếu hơn liên kết ion và liên kết cộng hóa trị.
-
Ảnh hưởng đến tính chất vật lý của chất như nhiệt độ sôi, độ nhớt.
-
Ví dụ: Liên kết hidro trong phân tử nước.
Bảng so sánh các loại liên kết:
|
Loại liên kết
|
Hình thành
|
Đặc điểm
|
|
Ion
|
Nhường nhận electron
|
Mạnh, tạo tinh thể, nhiệt độ nóng chảy cao
|
|
Cộng hóa trị
|
Góp chung electron
|
Đa dạng, có thể phân cực hoặc không
|
|
Kim loại
|
Electron tự do
|
Dẫn điện, dẫn nhiệt tốt, dẻo
|
|
Hiđro
|
Giữa H và F, O, N
|
Yếu, ảnh hưởng đến tính chất vật lý
|
Ứng dụng của liên kết hóa học trong cuộc sống
Liên kết hóa học, với sự đa dạng và tính đặc trưng của nó, đóng vai trò vô cùng quan trọng trong việc hình thành nên mọi vật chất xung quanh chúng ta. Từ những vật dụng nhỏ nhất đến những công trình kiến trúc đồ sộ, từ các phân tử sinh học đến các vật liệu công nghệ cao, đều chịu ảnh hưởng trực tiếp của các loại liên kết hóa học.Dưới đây là một số ứng dụng điển hình của liên kết hóa học trong cuộc sống:

Ứng dụng trong vật liệu xây dựng
1. Trong Vật Liệu
-
Vật liệu xây dựng: Liên kết ion trong các hợp chất như xi măng, vôi tạo nên độ bền và kết dính cho các công trình xây dựng.
-
Vật liệu kim loại: Liên kết kim loại mang đến cho kim loại tính dẻo, dẫn điện, dẫn nhiệt cao, ứng dụng rộng rãi trong các ngành công nghiệp.
-
Vật liệu polymer: Liên kết cộng hóa trị tạo nên các phân tử polymer dài, tạo ra các vật liệu nhựa, cao su với tính chất đa dạng.
-
Gốm sứ: Liên kết ion và cộng hóa trị tạo nên các vật liệu gốm sứ cứng, chịu nhiệt.
2. Trong Năng Lượng
-
Pin và ắc quy: Các phản ứng hóa học dựa trên sự chuyển dịch electron (liên kết hóa học) tạo ra dòng điện.
-
Nhiên liệu: Quá trình đốt cháy nhiên liệu là một loạt các phản ứng hóa học giải phóng năng lượng.
-
Năng lượng mặt trời: Các tế bào quang điện chuyển đổi ánh sáng thành điện năng dựa trên các phản ứng hóa học.
3. Trong Y học
-
Thuốc: Liên kết hóa học quyết định tính chất, tác dụng và cách thức hoạt động của thuốc.
-
Vật liệu y sinh: Các vật liệu như implant, stent được chế tạo dựa trên các liên kết hóa học đặc biệt để tương thích với cơ thể người.
4. Trong Thực Phẩm
-
Bảo quản thực phẩm: Các chất phụ gia thực phẩm thường tác động vào các liên kết hóa học trong thực phẩm để kéo dài thời gian bảo quản.
-
Chế biến thực phẩm: Nhiều quá trình chế biến thực phẩm liên quan đến các phản ứng hóa học, ví dụ như quá trình lên men để tạo ra sữa chua, rượu.
5. Trong Môi Trường
-
Xử lý nước thải: Các quá trình xử lý nước thải dựa trên các phản ứng hóa học để loại bỏ các chất ô nhiễm.
-
Bảo vệ môi trường: Các chất xúc tác được sử dụng để tăng tốc độ các phản ứng phân hủy chất thải hữu cơ.
6. Trong Công Nghiệp
-
Sản xuất hóa chất: Các phản ứng hóa học được sử dụng để sản xuất một loạt các hóa chất, từ axit, bazơ đến các hợp chất hữu cơ phức tạp.
-
Sản xuất vật liệu: Liên kết hóa học đóng vai trò quan trọng trong việc tạo ra các vật liệu mới như composite, nano vật liệu.
Liên kết hóa học là nền tảng của mọi sự vật hiện tượng xung quanh chúng ta. Việc hiểu rõ về các loại liên kết hóa học và ứng dụng của chúng giúp chúng ta giải thích các hiện tượng tự nhiên, phát triển các công nghệ mới và cải thiện chất lượng cuộc sống.
Quy tắc liên quan đến liên kết hóa học
Liên kết hóa học là cầu nối giữa các nguyên tử, tạo nên các phân tử và hợp chất. Để hiểu rõ hơn về sự hình thành và tính chất của các liên kết này, chúng ta cần nắm vững một số quy tắc cơ bản.
Quy Tắc Octet
-
Nguyên tắc: Các nguyên tử có xu hướng đạt được cấu hình electron bền vững của khí hiếm gần nhất (thường là 8 electron ở lớp ngoài cùng).
-
Ý nghĩa: Quy tắc octet giúp giải thích lý do tại sao các nguyên tử liên kết với nhau để tạo thành các hợp chất.
Quy Tắc Duet
-
Nguyên tắc: Đối với nguyên tử Hydro và Heli, cấu hình bền vững là khi lớp ngoài cùng có 2 electron.
-
Ý nghĩa: Quy tắc duet áp dụng cho các nguyên tử có số hiệu nguyên tử nhỏ.
Độ Âm Điện
Quy Tắc Liên Kết
-
Liên kết ion: Hình thành giữa kim loại và phi kim, dựa trên sự chênh lệch độ âm điện lớn.
-
Liên kết cộng hóa trị: Hình thành giữa các phi kim, dựa trên sự góp chung electron.
-
Liên kết kim loại: Hình thành giữa các nguyên tử kim loại, các electron tự do chuyển động trong mạng tinh thể.
-
Liên kết hiđro: Là liên kết yếu giữa nguyên tử H của một phân tử và nguyên tử F, O hoặc N của phân tử khác.
Quy Tắc Về Hình Học Phân Tử
Quy Tắc Liên Kết Đôi, Liên Kết Ba
-
Liên kết đôi: Hai nguyên tử góp chung 2 cặp electron.
-
Liên kết ba: Hai nguyên tử góp chung 3 cặp electron.
-
Ý nghĩa: Liên kết đôi và liên kết ba làm tăng độ bền của phân tử.
Quy Tắc Liên Kết Hiđro
-
Liên kết hiđro: Là liên kết yếu giữa nguyên tử H của một phân tử và nguyên tử F, O hoặc N của phân tử khác.
-
Ý nghĩa: Liên kết hiđro ảnh hưởng đến nhiệt độ sôi, độ nhớt của chất.
Các quy tắc trên chỉ là những nguyên tắc cơ bản, việc áp dụng chúng vào thực tế còn phụ thuộc vào nhiều yếu tố khác như cấu hình electron, kích thước nguyên tử, điều kiện môi trường.
Ví dụ:
-
Phân tử nước (H₂O): Nguyên tử O có độ âm điện lớn hơn H nên liên kết O-H là liên kết cộng hóa trị phân cực. Hình dạng phân tử nước là góc, do cặp electron chưa liên kết của O đẩy các cặp electron liên kết.
-
Phân tử muối ăn (NaCl): Natri (Na) nhường 1 electron cho Clo (Cl) tạo thành ion Na+ và Cl-. Lực hút tĩnh điện giữa hai ion trái dấu tạo thành liên kết ion.
Làm thế nào để xác định loại liên kết trong một hợp chất?
Để xác định loại liên kết trong một hợp chất, chúng ta thường dựa vào các yếu tố sau:
Có nhiều cách để xác định liên kết trong một chất
1. Độ Âm Điện
2. Bản Chất Của Các Nguyên Tố Tham Gia
-
Kim loại liên kết với phi kim: Thường tạo liên kết ion.
-
Phi kim liên kết với phi kim: Thường tạo liên kết cộng hóa trị.
-
Kim loại liên kết với kim loại: Tạo liên kết kim loại.
3. Tính Chất Của Hợp Chất
-
Hợp chất ion: Thường ở trạng thái rắn, có nhiệt độ nóng chảy và nhiệt độ sôi cao, tan trong nước và các dung môi phân cực, dẫn điện khi nóng chảy hoặc hòa tan trong nước.
-
Hợp chất cộng hóa trị: Thường ở trạng thái khí hoặc lỏng, có nhiệt độ nóng chảy và nhiệt độ sôi thấp, không dẫn điện.
-
Kim loại: Dẫn điện, dẫn nhiệt tốt, có ánh kim.
Lưu ý
Các bước xác định loại liên kết:
-
Viết công thức cấu tạo của hợp chất.
-
Xác định độ âm điện của các nguyên tử.
-
Tính hiệu độ âm điện.
-
Dựa vào hiệu độ âm điện và bản chất của các nguyên tử để kết luận.
Qua những thông tin chia sẻ trên của dongachem.vn có thể thấy liên kết hóa học không chỉ đơn thuần là một khái niệm trong sách vở mà còn là cốt lõi của mọi chất liệu mà chúng ta thấy hàng ngày. Những kết nối giữa các nguyên tử tạo nên thế giới phong phú và đa dạng xung quanh chúng ta, từ nước, không khí cho đến kim loại. Bằng cách hiểu rõ hơn về liên kết hóa học là gì, chúng ta không chỉ giải thích được sự hình thành của các chất mà còn có khả năng phát triển và chế tạo ra những sản phẩm mới, ứng dụng mạnh mẽ vào cuộc sống hàng ngày. Vì vậy, liên kết hóa học không chỉ đơn giản là một phần kiến thức học thuật, mà là một phần thiết yếu trong việc khám phá và làm chủ thế giới vật chất.