CuCO₃, hay còn gọi là đồng(II) cacbonat, là một hợp chất hóa học quan trọng trong lĩnh vực hóa học và công nghiệp. Hợp chất này có công thức phân tử CuCO₃ và thường xuất hiện dưới dạng rắn, có màu xanh lá cây nhạt đến xanh lam. Đây là hợp chất có ứng dụng đa dạng trong công nghiệp, từ sản xuất đồng, chất màu đến các ứng dụng trong ngành dược phẩm. Để hiểu rõ hơn tính chất, ứng dụng cụ thể của đồng II cacbonat, hãy cùng Đông Á Chemical tìm hiểu bài viết sau đây với chủ đề CuCO₃ là gì các bạn nhé!
Chi tiết công thức hóa học của CuCO₃
CuCO₃ là hợp chất chứa cation đồng(II) (Cu²⁺) và anion cacbonat (CO₃²⁻). Cấu trúc phân tử của nó được đặc trưng bằng cách liên kết các nguyên tử đồng với các nguyên tử oxy và cacbon. Một cách đơn giản để mô tả công thức hóa học CuCO₃ là:
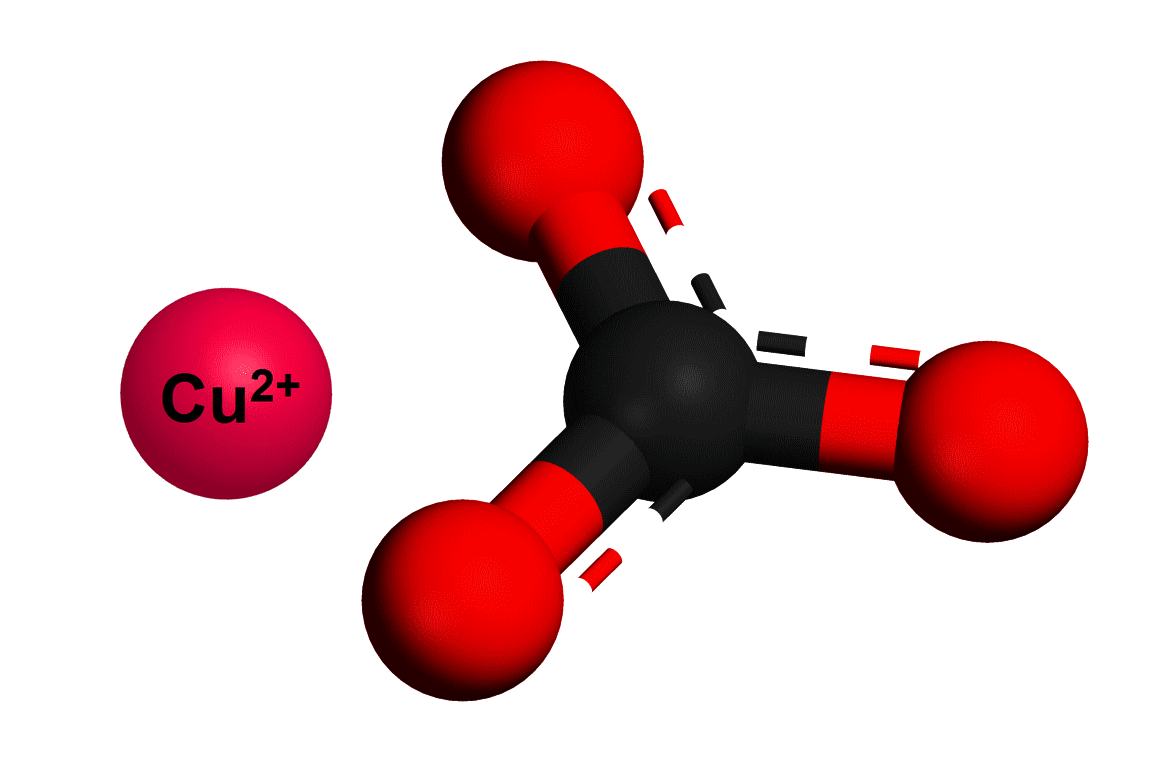
Liên kết hóa học của CuCO₃
-
Cation: Cu²⁺
-
Anion: CO₃²⁻
Hình thức tạo nên CuCO₃ tương tự như một bức tranh hòa quyện giữa đồng và cacbon, với mỗi nguyên tử trong cấu trúc này có vai trò riêng biệt trong việc duy trì tính chất của hợp chất. Các liên kết hóa học bên trong đồng(II) cacbonat cũng rất mạnh mẽ, giúp tạo ra độ bền cho hợp chất này, đồng thời việc phân hủy dễ dàng dưới nhiệt độ cao lại cho thấy tính nhạy bén của nó.
Tính chất vật lý của CuCO₃
Đồng(II) cacbonat (CuCO₃) là một hợp chất vô cơ có màu xanh lục đặc trưng. Nó thường tồn tại trong tự nhiên dưới dạng khoáng vật malachite. Dưới đây là một số tính chất vật lý nổi bật của CuCO₃:

Đồng II cacbonat tồn tại dưới dạng tinh thể rắn màu xanh lục
-
Trạng thái: Rắn, tinh thể.
-
Màu sắc: Xanh lục.
-
Mùi vị: Không mùi.
-
Độ tan: Ít tan trong nước.
-
Khối lượng riêng: Khoảng 3.95 g/cm³.
-
Điểm nóng chảy: Phân hủy trước khi nóng chảy.
-
Độ cứng: Khá mềm.
-
Phân hủy: CuCO₃ không bền trong không khí ẩm và dễ dàng phân hủy thành đồng(II) oxit (CuO) và khí carbon dioxide (CO₂).
-
Ảnh hưởng của nhiệt độ: Khi đun nóng, CuCO₃ phân hủy hoàn toàn thành CuO và CO₂.
Tính chất hóa học của CuCO₃
CuCO₃ có những tính chất hóa học đặc trưng khiến nó trở thành một hợp chất quan trọng trong nghiên cứu và ứng dụng công nghiệp. Dưới đây là một số phản ứng hóa học điển hình:
Tính chất hóa học của CuCO₃
1. Phản ứng phân hủy nhiệt:
Khi đun nóng, CuCO₃ dễ dàng phân hủy thành đồng(II) oxit (CuO) và khí cacbon đioxit (CO₂): CuCO₃ (r) → CuO (r) + CO₂ (k)
2. Tác dụng với axit:
Đồng(II) cacbonat là một bazơ yếu, do đó nó phản ứng với axit tạo thành muối đồng(II) tương ứng và giải phóng khí CO₂:
CuCO₃ (r) + 2HCl (dd) → CuCl₂ (dd) + H₂O (l) + CO₂ (k)
3. Tác dụng với dung dịch kiềm:
Đồng(II) cacbonat không tan trong nước và không phản ứng với dung dịch kiềm.
4. Tác dụng với một số muối:
Đồng(II) cacbonat có thể phản ứng với một số muối tạo thành các kết tủa mới. Ví dụ:
CuCO₃ (r) + 2AgNO₃ (dd) → Cu(NO₃)₂ (dd) + Ag₂CO₃ (r)
Ứng dụng của CuCO₃ trong công nghiệp
CuCO₃ có nhiều ứng dụng quan trọng trong các lĩnh vực công nghiệp khác nhau, vô cùng đa dạng và phong phú, bao gồm:
1. Ngành sơn và màu:

Ứng dụng trong ngành sơn và pha chế màu
-
Chất tạo màu: Màu xanh lục tự nhiên của đồng(II) cacbonat₃ được sử dụng rộng rãi để tạo ra các sắc tố cho sơn, mực in và các vật liệu nhuộm màu khác.
-
Chất chống ăn mòn: Khi kết hợp với các chất khác, CuCO₃ có thể giúp tăng cường khả năng chống ăn mòn của lớp sơn.
2. Ngành gốm sứ:
3. Ngành nông nghiệp:
-
Phân bón vi lượng: Đồng là một nguyên tố vi lượng cần thiết cho sự phát triển của cây trồng. Đồng(II) cacbonat được sử dụng làm phân bón để cung cấp đồng cho cây trồng, giúp tăng năng suất và chất lượng nông sản.
-
Chất bảo vệ thực vật: Đồng(II) cacbonat có tính kháng khuẩn và nấm, vì vậy nó được sử dụng trong một số loại thuốc trừ nấm để bảo vệ cây trồng khỏi bệnh hại.
4. Ngành sản xuất thủy tinh:
5. Các ứng dụng khác:
-
Sản xuất hóa chất: Đồng(II) cacbonat được sử dụng làm nguyên liệu để sản xuất các hợp chất đồng khác.
-
Ngành dược phẩm: Trong một số trường hợp, CuCO₃ được sử dụng trong sản xuất một số loại thuốc.
Lưu ý:
-
Mặc dù có nhiều ứng dụng hữu ích, nhưng đồng(II) cacbonat cũng là một chất độc hại nếu hít phải hoặc nuốt phải. Vì vậy, khi làm việc với CuCO₃, cần tuân thủ các biện pháp an toàn để bảo vệ sức khỏe.
-
Việc sử dụng đồng(II) cacbonat trong một số lĩnh vực đang dần bị hạn chế do những lo ngại về tác động môi trường.
Lưu ý khi sử dụng đồng(II) cacbonat
Khi làm việc với đồng(II) cacbonat, cần chú ý đến các lưu ý an toàn và sử dụng sau đây:

Lưu ý khi sử dụng đồng(II) cacbonat
-
An toàn lao động: Mặc dù đồng(II) cacbonat không độc, nhưng vẫn cần sử dụng thiết bị bảo hộ cá nhân như găng tay và kính bảo hộ khi làm việc với bột CuCO₃. Không gian làm việc cần thông thoáng để tránh hít phải bụi.
-
Bảo quản: Đồng(II) cacbonat nên được bảo quản trong thùng kín, ở nơi khô ráo và mát mẻ để tránh phân hủy do độ ẩm. Nếu để lâu trong môi trường ẩm ướt, CuCO₃ có thể dễ dàng phân hủy thành các hợp chất khác.
Việc nắm rõ các lưu ý khi sử dụng đồng(II) cacbonat sẽ giúp người dùng đảm bảo an toàn trong công việc cũng như bảo quản hợp chất một cách hiệu quả nhất.
Cách tổng hợp đồng(II) cacbonat
Đồng(II) cacbonat là một hợp chất khá đặc biệt, vì trong điều kiện bình thường, nó khá khó để tổng hợp ở dạng tinh khiết. Lý do chính là vì CuCO₃ không bền trong nước và dễ dàng bị phân hủy thành các hợp chất khác như đồng hidroxit cacbonat (malachit).
Tuy nhiên, các nhà khoa học đã tìm ra một số phương pháp để tổng hợp đồng(II) cacbonat, tuy nhiên các phương pháp này thường yêu cầu điều kiện nhiệt độ và áp suất cao.
1. Phương pháp nhiệt phân muối đồng:
-
Nguyên tắc: Đun nóng các muối đồng như đồng nitrat hoặc đồng sunfat trong khí quyển CO₂ ở nhiệt độ và áp suất cao.
-
Phản ứng: CuSO₄ + Na₂CO₃ → CuCO₃ + Na₂SO₄
-
Điều kiện: Phản ứng thường được thực hiện ở nhiệt độ khoảng 180°C và áp suất CO₂ khoảng 450 atm.
-
Nhược điểm: Phương pháp này đòi hỏi thiết bị chuyên dụng và điều kiện làm việc nghiêm ngặt.
2. Phương pháp sử dụng chất kết tủa:
-
Nguyên tắc: Cho dung dịch muối đồng (II) tác dụng với dung dịch muối cacbonat trong điều kiện lạnh và khuấy đều.
-
Phản ứng: CuSO₄ + Na₂CO₃ → CuCO₃↓ + Na₂SO₄
-
Nhược điểm: Kết tủa thu được thường không phải là CuCO₃ tinh khiết mà là hỗn hợp của CuCO₃ và Cu(OH)₂.
3. Phương pháp điện hóa:
Lưu ý:
-
CuCO₃ không bền: Dù được tổng hợp bằng phương pháp nào, CuCO₃ cũng rất dễ bị phân hủy khi tiếp xúc với nước hoặc không khí ẩm. Vì vậy, việc bảo quản đồng(II) cacbonat cần được thực hiện trong điều kiện khô ráo.
-
Độ tinh khiết thấp: Các sản phẩm thu được từ các phương pháp trên thường không phải là CuCO₃ tinh khiết 100% mà là hỗn hợp của CuCO₃ và các hợp chất khác.
-
Điều kiện phản ứng khắc nghiệt: Các phương pháp tổng hợp CuCO₃ thường yêu cầu điều kiện nhiệt độ và áp suất cao, đòi hỏi thiết bị chuyên dụng và kỹ thuật cao
Cách nhận biết CuCO₃ trong phòng thí nghiệm
Trong phòng thí nghiệm, việc nhận biết CuCO₃ là một quy trình quan trọng và có thể thực hiện qua nhiều cách:
-
Quan sát hình dáng và màu sắc:đồng(II) cacbonat thường xuất hiện dưới dạng tinh thể hoặc bột màu xanh.
-
Phản ứng với axit: Khi cho CuCO₃ vào axit HCl, sẽ xảy ra phản ứng sinh ra khí CO₂: CuCO₃ + 2HCl → CuCl₂ + H₂O + CO₂. Khi cho CuCO₃ vào dung dịch HCl, ta sẽ thấy các bọt khí sủi lên. Đó chính là khí CO₂ thoát ra. Dung dịch chuyển sang màu xanh lam, do sự hình thành của muối đồng(II) clorua (CuCl₂).
-
Kiểm tra độ tan: CuCO₃ không tan trong nước nhưng hòa tan trong axit, giúp xác định hợp chất đầy rõ ràng.
Việc áp dụng các phương pháp này không chỉ giúp xác nhận CuCO₃ mà còn thể hiện những hiểu biết sâu sắc về các phản ứng hóa học mà hợp chất này tham gia.
Vai trò của CuCO₃ trong tự nhiên
CuCO₃ không chỉ có các ứng dụng trong công nghiệp mà còn giữ vai trò quan trọng trong tự nhiên. Một số điểm nổi bật về vai trò của CuCO₃ bao gồm:
-
Nguồn gốc và vai trò địa chất: CuCO₃ là thành phần tự nhiên có trong nhiều loại khoáng vật như malachite và azurite, có giá trị trong khai thác khoáng sản.
-
Ứng dụng trong nông nghiệp: Đồng(II) cacbonat được sử dụng làm phụ gia trong phân bón, cung cấp đồng cho cây trồng, giúp cải thiện sức khỏe thực vật.
-
Phản ứng hóa học tự nhiên: Đồng(II) cacbonat tham gia vào quá trình sản xuất khí carbon dioxide, ảnh hưởng đến môi trường và khí quyển.
CuCO₃ thực sự là một phần không thể thiếu trong chu trình tự nhiên, giúp duy trì cân bằng sinh thái và đóng góp vào các tiến trình hóa học có ý nghĩa sinh tồn.
CuCO₃ hay đồng(II) cacbonat, nổi bật không chỉ nhờ những tính chất hóa học và vật lý độc đáo mà còn qua sự đa dạng trong ứng dụng công nghiệp và vai trò trong tự nhiên. Việc hiểu rõ về CuCO₃ là gì không chỉ giúp chúng ta khai thác tốt hơn nguồn tài nguyên này mà còn thể hiện ý thức trong việc bảo vệ môi trường. Hợp chất này không chỉ là một phần của cuộc sống hàng ngày mà còn là nền tảng cho sự tiến bộ của nhiều ngành công nghiệp. Sự kết hợp giữa giá trị thực tiễn và lý thuyết giúp CuCO₃ là một trong những hợp chất không thể thiếu trong đời sống hiện đại.
Cảm ơn các bạn đã dành thời gian theo dõi bài viết chủ đề “CuCO₃ là gì” của Đông Á Chemical, để xem thêm nhiều bài viết chủ đề khác vui lòng truy cập website dongachem.vn các bạn nhé!