Bazơ là gì?
Khái niệm bazơ là gì?
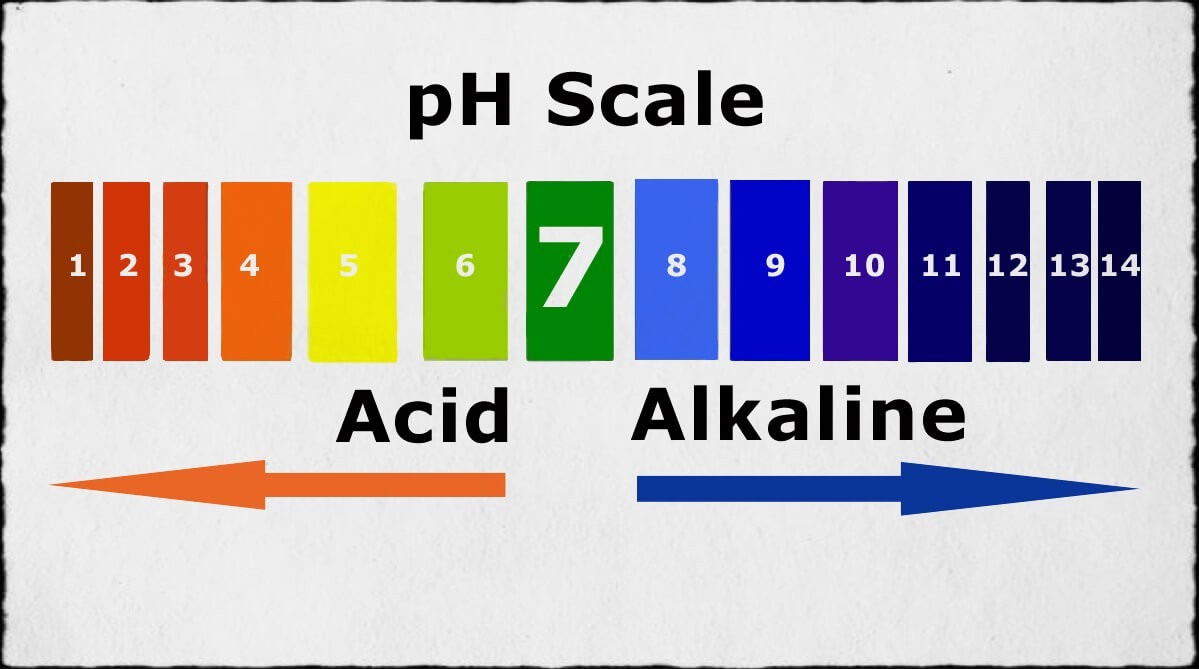
Bazơ là chất chỉ bao gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm - OH (hydroxit). Ngoài ra, cũng có thể hiểu bazơ là hợp chất hoá học khi tan trong axit sẽ hình thành nên dung dịch có độ pH lớn hơn 7. Đây cũng là đặc điểm nổi bật của dung dịch bazơ.
Bazơ có công thức chung hay gặp dạng X(OH)n. Trong đó:
-
X là một kim loại trong nhóm các nguyên tố hoá học. Khác với axit là hợp chất của những nguyên tố phi kim, bazơ là hợp chất của những nguyên tố kim loại.
-
n là hoá trị của kim loại trên. Sở dĩ nhóm - OH hóa trị 1, nghĩa là số nhóm - OH gắn liền với một nguyên tử kim loại sẽ tương ứng với hoá trị của kim loại ấy.
Ngoài ra cũng có một vài dạng bazơ không có cấu tạo từ nguyên tố kim loại. Nhưng có đủ những đặc tính của một bazơ (tính chất của nhóm -OH), điển hình như amoniac (NH 3 OH), bazơ có chứa vòng thơm (C6H5OH).
Để đặt tên một bazơ, danh pháp hoá học của bazơ được cấu tạo thành bởi: Tên nguyên tố (cùng hoá trị nếu kim loại có nhiều hoá trị) + hydroxit (tên nhóm - OH). Ví dụ như: Ca (OH) 2 đọc là “Canxi hydroxit” hay Cu (OH) 2 có tên gọi là “Đồng (II) hidroxit”
Phân loại các hợp chất bazơ
Bazơ được cấu tạo bởi những nguyên tử kim loại và có những tính chất vật lý, hoá học khác nhau. Dựa trên những đặc tính đó ta phân biệt bazơ theo nhiều cách khác nhau
-
Dựa vào thành phần cấu tạo của bazơ được chia làm 2 loại: Bazơ mạnh của các kim loại kiềm như NaOH, KOH, Ca(OH)2, Ba(OH)2. Và nhóm bazơ bền như Fe(OH)3, Al(OH)3
-
Dựa vào độ tan của bazơ trong nước ( H2O) ta phân bazơ làm 2 loại: Bazơ tan hay còn gọi chất tan của bazơ đó là axit như NaOH, KOH. Và nhóm bazơ không tan như Ba(OH)2, Cu(OH)2
-
Dựa theo tính chất của bazơ có thể chia thành: Bazơ vô cơ gồm NaOH, Al(OH)3 và nhóm bazơ không chứa kim loại như amoniac (NH3OH), các amin có tính bazơ, các hợp chất có tính bazơ chứa vòng thơm như C6H5OH.
Một số tính chất cơ bản của bazơ
Cũng giống như các hợp chất hóa học khác, bazo cũng có cho mình những tính chất đặc trưng. Thể hiện được trạng thái và khả năng tham gia vào nhiều phản ứng hóa học khác nhau.
Tính chất vật lý của bazơ
Bazơ thường tồn tại ở dạng chất rắn, tinh thể, hoặc dưới dạng lỏng (kiềm hay có tính axit). Bazơ có nồng độ cao và bazơ mạnh sẽ tác dụng nhanh và mạnh với những chất axit và có tính ăn mòn mạnh.
Bazơ sẽ gây ra mùi tanh hoặc nhớt, như NaOH trong xà bông giặt rửa. Bazơ tan được trong nước thì dung dịch thường không có màu, bazơ kết rắn không tan trong dung dịch thì có màu, chẳng hạn dung dịch Ba(OH)2 màu trắng, Cu(OH)2 màu xanh nước biển.
Tính chất hoá học của bazơ
Tính chất hóa học của bazơ được thể hiện thông qua những phản ứng hóa học cơ bản cho đến nâng cao. Cụ thể như:
-
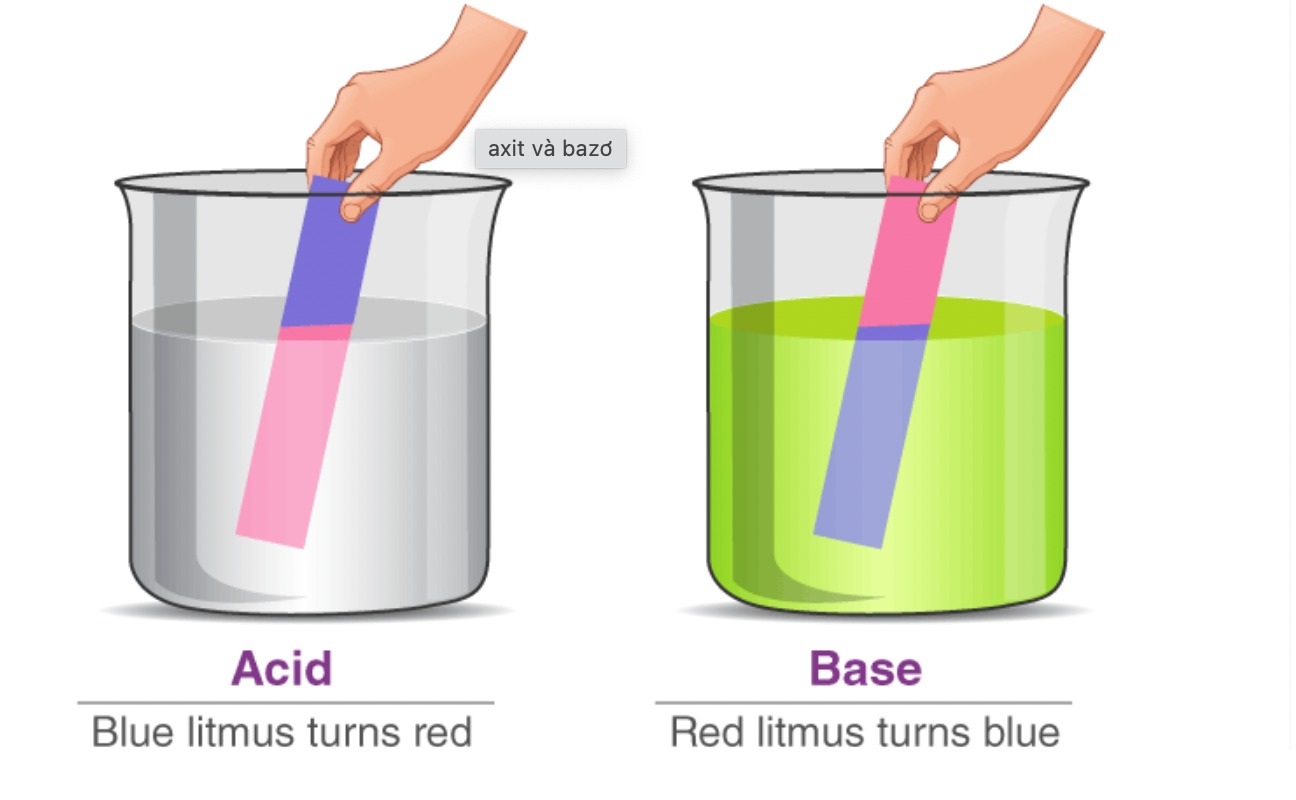
Tác dụng với chỉ thị màu; Dung dịch bazơ làm quỳ tím chuyển sang màu xanh, làm phenolphtalein không màu đổi thành màu đỏ.
-
Dung dịch bazơ tác dụng với oxit axit: Phương trình phản ứng xảy ra dưới sự phản ứng của bazơ + oxit axit -> muối + axit
-
Bazơ tác dụng với axit: Bazơ + axit -> muối + axit, phương trình xảy ra với cả bazo tan và bazơ không tan
-
Dung dịch bazơ tác dụng với nhiều dung dịch muối: Phản ứng khử gốc axit tạo nên muối mới và bazơ mới.
-
Bazơ (không tan) bị nhiệt phân: Phản ứng bazơ nhiệt phân ở nhiệt độ thích hợp thu được oxit + nước
Lưu ý: Trong những đặc tính trên, có một số đặc tính xảy ra với dung dịch bazơ, là bazơ ở thể lỏng, tan được trong nước. Một số khác xảy ra với bazơ không hòa tan ở thể rắn, không hòa tan trong nước hoặc xảy ra với cả hai loại bazơ.
NaOH - Bazơ điển hình nhất và vai trò của chúng trong đời sống

Công thức hóa học của Natri hiđroxit là NaOH, phân tử khối M = 40 đvC có tên hóa học là Xút a. Natri hidroxit là chất rắn không màu, hút ẩm mạnh, hoà tan tốt trong dầu và tỏa nhiệt. Dung dịch NaOH có tính chất ăn mòn, gây bục vải giấy và ăn mòn da. Khi dùng NaOH phải rất cẩn thận.
Về tính chất hoá học, Natri hydroxit có đầy đủ tính chất của một bazơ tan (kiềm). Có thể làm chuyển màu chất chỉ thị như làm chuyển màu quỳ tím sang xanh lam, dung dịch phenolphtalein không màu sang đỏ. Tác dụng với axit tạo nên muối và dung dịch (phản ứng thuận). Và tác dụng với dung dịch muối cho muối mới và bazo mới.
Natri hidroxit có nhiều công dụng trong cuộc sống và trong sản xuất và dùng trong:
-
Sản xuất xà phòng phognf, chất tẩy, bột giặt.
-
Sản xuất bột giấy, tơ nhân tọa, trong chế biến dầu khí.
-
Sản xuất alumin (rửa sạch quặng nhôm trước khi sản xuất).
Trong phòng thí nghiệm, NaOH được sản xuất theo phương pháp điện phân dung dịch NaCl bão hoà. Thùng điện phân có màng ngăn cách giữa cực âm và cực dương: 2 NaCl + 2 H2O - - (điện phân có màng ngăn) - -> 2 NaOH + H2 + Cl2
Natri hydroxit có ứng dụng rộng rãi trong ngành công nghiệp làm xà phòng, bột giấy, tơ nhân tạo, dầu thực vật, phẩm nhuộm, ... Dùng làm thuốc thử thông dụng trong các phòng thí nghiệm bởi độ an toàn cao. Hiện nay, loại NaOH đang được dùng phổ biến nhất là NaOH dạng rắn nồng độ 99% và NaOH dạng lỏng nồng độ 20% - 50%.
NaOH và một số bazơ tan được trong dầu cũng được ứng để khử trùng nước, đặc biệt là nước trong hồ bơi khi bazơ tan trong nước và tăng nồng độ pH. Ngoài ra, bazơ cũng được sử dụng để tẩy rửa và khử cặn vôi trong ống nước sinh hoạt tạo ra từ những gốc không tan do muối của các bazơ tan như NaOH, KOH không tan được trong nước và sẽ bị rửa trôi đi.
NaOH và một số bazơ còn có ứng dụng cao trong ngành công nghiệp dầu khí. Thông qua tác dụng ổn định pH cho dung dịch kiềm, loại bỏ sulphur (gốc =SO4) và những hợp chất sulphur hay các axit có trong tính chế dầu mỏ.
NaOH cũng được dùng trong các dung dịch có gốc Na (Sodium). Vậy nên có thể tham khảo thêm trong bảng thành phần của các loại mỹ phẩm, hoá chất, nước tẩy rửa như Javen, thuốc Aspirin, dung dịch sát trùng, ... Đặc biệt NaOH được sử dụng để làm sạch dầu do tác dụng thuỷ phân chất béo trong dầu.
Một vài loại bazơ thông dụng khác
Ngoài những bazơ quan trọng và có tính bazơ mạnh, cũng có một số bazơ khác như:
Canxi hidroxit - Ca (OH)2
Canxi hydroxit là một bazơ mạnh có đủ đặc tính cơ bản của một bazơ. Trong nông nghiệp, Ca (OH) 2 được dùng rộng rãi phục vụ việc xử lí nước thải và cải tạo đất bị nhiễm mặn (nhiễm axit). Trong công nghiệp, Ca(OH)2 được sử dụng rộng rãi trong sản xuất hoá chất phụ gia thực phẩm, xử lý nước thải sản xuất thức uống như rượu bia hay thức uống không cồn.
Kali hydroxit - KOH
Kali hydroxit (hay còn gọi là Potash) tồn tại dưới dạng chất rắn tinh thể màu trắng, có tính hút nước, hút ẩm, tan hoàn toàn trong nước. Đây là một bazơ mạnh điển hình, phản ứng với H2O (nước) dễ dàng và sinh khí CO2 để tạo ra hợp chất Kali cacbonat (K2CO3).
KOH ở dạng dung dịch có tác dụng ăn mòn nhôm, sắt, thép, nhựa; ở dạng rắn đun nóng KOH còn phá huỷ cả gốm sứ, platin.
Đồng (II) hidroxit - Cu(OH)2
Cu(OH)2 là một bazơ dạng rắn, màu xanh nước biển, không tan trong ete, có thể tan trong các dung dịch axit, amoniac đậm đặc Cu (NH3) và đặc biệt dễ tan trong dung dịch NaOH 40% đun sôi.
Trên đây là nội dung bài viết của hóa chất Đông Á về bazơ là gì? Cùng với đó là một số tính chất quan trọng của hợp chất bazơ. Hy vọng bài viết đã cung cấp tới cho bạn các thông tin bổ ích. Trân trọng cảm ơn!